ÇÖLYAK HASTALIĞI
Çölyak hastalığı, esas olarak ince bağırsağı etkileyen uzun süreli bir bağışıklık bozukluğudur. Klasik semptomlar arasında kronik ishal, abdominal distansiyon, malabsorbsiyon, iştahsızlık gibi gastrointestinal problemler ve çocuklar arasında normal büyümede başarısızlık yer alır. Bu genellikle altı ay ile iki yaş arasında başlar Klasik olmayan belirtiler özellikle iki yaşından büyük kişilerde daha yaygındır. Hafif veya hiç olmayan gastrointestinal semptomlar, vücudun herhangi bir bölümünü ilgilendiren çok sayıda semptom olabilir veya belirgin semptomlar olmayabilir. Çölyak hastalığı ilk olarak çocuklukta tanımlanmıştır; ancak her yaşta gelişebilir. Diğerlerinin yanı sıra Tip 1 diabetes mellitus ve Hashimoto tiroiditi gibi diğer otoimmün hastalıklarla ilişkilidir.
Çölyak hastalığına, buğdayda ve arpa ve çavdar gibi diğer tahıllarda bulunan çeşitli proteinler grubu olan glütene reaksiyon neden olur. Diğer glüten içeren tahıllarla kontaminasyon içermeyen orta miktarlarda yulaf genellikle tolere edilir. Sorunların ortaya çıkması yulaf çeşidine bağlı olabilir. Genetik yatkınlığı olan insanlarda ortaya çıkar. Glütene maruz kalındığında, anormal bir bağışıklık tepkisi, bir dizi farklı organı etkileyebilecek birkaç farklı otoantikor üretimine yol açabilir. İnce bağırsakta bu, iltihaplı bir reaksiyona neden olur ve ince bağırsağı kaplayan villusun kısalmasına (villöz atrofi) neden olabilir. Bu, besinlerin emilimini etkiler ve sıklıkla anemiye yol açar.
Teşhis, tipik olarak, spesifik genetik testlerin yardımıyla, kan antikor testleri ve bağırsak biyopsilerinin bir kombinasyonu ile yapılır. Teşhisi yapmak her zaman kolay değildir. Sıklıkla kandaki otoantikorlar negatiftir ve çoğu insan normal villuslarda sadece küçük bağırsak değişikliklerine sahiptir. Kişiler şiddetli semptomlara sahip olabilir ve bir tanı konulmadan önce yıllarca araştırılabilir. Tarama sonucunda semptomları olmayan kişilerde giderek artan bir şekilde tanı konulmaktadır. Bununla birlikte, taramanın etkilerine ilişkin kanıt, yararlılığını belirlemek için yeterli değildir. Hastalık, glüten proteinlerine kalıcı bir tahammülsüzlükten kaynaklanırken, çok daha nadir görülen buğday alerjisinden farklıdır.
Bilinen tek etkili tedavi, çoğu insanda bağırsak mukozasının iyileşmesine yol açan, semptomları iyileştiren ve komplikasyon gelişme riskini azaltan katı bir ömür boyu glutensiz diyettir. Tedavi edilmezse, bağırsak lenfoması gibi kanserler ve biraz artan erken ölüm riskiyle sonuçlanabilir. Oranlar dünyanın farklı bölgeleri arasında değişiyor, 300'de 1'den 40'da 1'e kadar, ortalama 100'de 1 ile 170 kişide 1 arasında. Vakaların% 80'inin, genellikle gastrointestinal şikayetlerin minimal veya hiç olmaması ve semptomlar ve tanı kriterleri hakkında bilgi eksikliği nedeniyle tanı konulmadığı tahmin edilmektedir. Çölyak hastalığı kadınlarda erkeklerden biraz daha yaygındır.
Belirti ve bulgular;
Tedavi edilmeyen çölyak hastalığının klasik semptomları arasında soluk, gevşek veya yağlı dışkı (steatorrhoea) ve kilo kaybı veya kilo alamama bulunur. Diğer yaygın semptomlar hafif olabilir veya esas olarak bağırsağın kendisi dışındaki organlarda ortaya çıkabilir. Klasik semptomların hiçbiri olmaksızın çölyak hastalığına sahip olmak da mümkündür. Bunun çocuklardaki sunumların en az% 43'ünü oluşturduğu gösterilmiştir. Ayrıca, hafif hastalığı olan birçok yetişkin sadece yorgunluk veya anemi ile gelebilir. Kendilerini asemptomatik olarak gören pek çok tanı konmamış birey aslında değil, bunun yerine kronik olarak riskli bir sağlık durumunda yaşamaya alışmış durumda. Aslında, glütensiz bir diyet başlattıktan ve müteakip iyileşme aşikar hale geldikten sonra, bu tür bireyler çoğu zaman, yanlışlıkla görmezden geldikleri tedavi edilmemiş hastalıklarının önceki semptomlarını geriye dönük olarak hatırlayabilir ve tanıyabilir.
Gastrointestinal
Çölyak hastalığının özelliği olan ishal kroniktir, bazen soluk, büyük hacimli ve anormal derecede kötü kokuludur. Karın ağrısı, kramplar, karın şişkinliği (bağırsak gazının fermentatif üretimine bağlı olduğu düşünülmektedir) ve ağız ülseri mevcut olabilir. Bağırsak daha fazla hasar gördükçe, bir dereceye kadar laktoz intoleransı gelişebilir. Sıklıkla semptomlar irritabl bağırsak sendromuna (IBS) atfedilir ve ancak daha sonra çölyak hastalığı olarak kabul edilir. IBS semptomları olan kişilerin popülasyonlarında, vakaların yaklaşık% 3,3'ünde veya genelden 4 kat daha fazla çölyak hastalığı tanısı konulabilir. Bunların çölyak hastalığı için taranması, Ulusal Sağlık ve Klinik Mükemmeliyet Enstitüsü (NICE), İngiliz Gastroenteroloji Derneği ve Amerikan Gastroenteroloji Koleji tarafından önerilmektedir, ancak Kuzey Amerika'da belirsiz bir yararı vardır.
Çölyak hastalığı, ince bağırsakta hem adenokarsinom hem de lenfoma (enteropati ile ilişkili T hücreli lenfoma (EATL) veya diğer Hodgkin olmayan lenfomalar) riskinde artışa yol açar. Bu risk kardeşler, ebeveynler ve çocuklar gibi birinci derece akrabalarda da daha yüksektir. Glutensiz bir diyetin bu riski temel seviyeye getirip getirmediği net değildir. Uzun süredir devam eden ve tedavi edilmeyen hastalık, ülseratif jejunit (ince bağırsakta ülser oluşumu) ve daralma (bağırsağın tıkanması ile skar oluşması sonucu daralma) gibi başka komplikasyonlara yol açabilir.
Malabsorbsiyonla ilgili
Bağırsaktaki değişiklikler, besinleri, mineralleri ve yağda çözünen A, D, E ve K vitaminlerini daha az emmesini sağlar.
- Karbonhidratların ve yağların malabsorbsiyonu kilo kaybına (veya çocuklarda büyümede başarısızlığa veya yetersiz büyümeye) ve yorgunluk veya enerji eksikliğine neden olabilir.
- Anemi birkaç şekilde gelişebilir: demir emilim bozukluğu demir eksikliği anemisine neden olabilir ve folik asit ve vitamin B12 emilim bozukluğu megaloblastik anemiye yol açabilir.
- Kalsiyum ve D vitamini malabsorpsiyonu (ve telafi edici sekonder hiperparatiroidizm) osteopeni (kemiğin mineral içeriğinin azalması) veya osteoporoza (kemik zayıflaması ve kırılganlık kırılma riski) neden olabilir.
Çölyak hastalığında selenyum emilim bozukluğu, glütensiz birçok gıdada düşük selenyum içeriği ile birleştiğinde, selenyum eksikliği riski oluşturur,
- Bakır ve çinko eksiklikleri de çölyak hastalığı ile ilişkilendirilmiştir.
- Küçük bir kısmında K vitamini eksikliği nedeniyle anormal pıhtılaşma var ve anormal kanama riski az.
Çeşitliği
Çölyak hastalığı bir dizi durumla ilişkilendirilmiştir. Çoğu durumda, glüten kaynaklı bağırsak hastalığının nedensel bir faktör olup olmadığı veya bu koşulların ortak bir yatkınlığı paylaşıp paylaşmadığı belirsizdir.
Çölyak hastalığı olan kişilerin% 2.3'ünde IgA eksikliği mevcuttur ve kendisi on kat artmış çölyak hastalığı riski ile ilişkilidir. Bu durumun diğer özellikleri, enfeksiyon ve otoimmün hastalık riskinin artmasıdır.
Kaşıntılı bir kutanöz durum olan dermatitis herpetiformis, ciltteki bir transglütaminaz enzimine bağlanmıştır, çölyak hastalığında olanlarla aynı ince bağırsak değişikliklerine sahiptir ve gastrointestinal semptomlar olmasa bile glüten çekilmesine yanıt verebilir.
Daha sonraki çocuklukta büyüme geriliği ve / veya ergenlik gecikmesi, bariz bağırsak semptomları veya ciddi yetersiz beslenme olmasa bile ortaya çıkabilir. Büyüme başarısızlığının değerlendirilmesi genellikle çölyak taramasını içerir.
Çölyak hastalığı önceden mevcutsa veya daha sonra edinilmişse, düşük, intrauterin büyüme kısıtlaması, düşük doğum ağırlığı ve erken doğum gibi önemli sonuçlarla birlikte gebelik komplikasyonları ortaya çıkabilir.
Hiposplenizm (küçük ve yetersiz bir dalak) vakaların yaklaşık üçte birinde ortaya çıkar ve dalağın bakterilere karşı korunmadaki rolü göz önüne alındığında enfeksiyona yatkınlık yaratabilir.
Anormal karaciğer fonksiyon testleri (kan testlerinde rastgele saptanan) görülebilir.
Çölyak hastalığı, çoğu otoimmün bozukluk olan birkaç başka tıbbi durumla ilişkilidir: diabetes mellitus tip 1, hipotiroidizm, birincil biliyer kolanjit, mikroskobik kolit, glüten ataksisi, sedef hastalığı, vitiligo, otoimmün hepatit, dermatit herpetiformis, birincil sklerozan kolanjit ve daha fazlası.
Nedeni;
Çölyak hastalığına, buğdayda bulunan gliadinlere ve glüten proteinlerine (glüten proteinleri) ve Triticeae kabilesinin (arpa ve çavdar gibi diğer yaygın tahılları içeren) ve Aveneae kabilesinin (yulaf) ekinlerinde bulunan benzer proteinlere bir reaksiyon neden olur. Buğday alt türleri (hecelenmiş, durum ve Kamut gibi) ve buğday melezleri (tritikale gibi) da çölyak hastalığının semptomlarına neden olur.
Çölyak hastası az sayıda insan yulaf reaksiyonu gösterir. Çölyak hastalarında yulaf toksisitesi, yulaf çeşitleri arasında farklı olan prolamin genleri, protein amino asit dizileri ve toksik prolaminlerin immünoreaktiviteleri nedeniyle tüketilen yulaf çeşidine bağlıdır. Ayrıca yulaf, glüten içeren diğer tahıllarla sıklıkla çapraz kontamine olur. "Saf yulaf", diğer glüten içeren tahıllarla kirletilmemiş yulaf anlamına gelir. Saf yulaf tüketiminin uzun vadeli etkileri hala belirsizdir ve glütensiz diyete dahil edilmeleri konusunda nihai tavsiyelerde bulunmadan önce, kullanılan çeşitleri tanımlayan daha fazla çalışmaya ihtiyaç vardır. Yulaf tüketmeyi seçen çölyak hastalarının, muhtemelen bağırsak biyopsilerinin periyodik performansı da dahil olmak üzere daha sıkı bir yaşam boyu takibe ihtiyacı vardır.
Diğer tahıllar
Mısır, darı, sorgum, teff, pirinç ve yabani pirinç gibi diğer tahıllar çölyak hastalarının yanı sıra amarant, kinoa ve karabuğday gibi hububat olmayanların tüketmesi için güvenlidir. Patates ve muz gibi tahıl içermeyen karbonhidrat açısından zengin besinler glüten içermez ve semptomları tetiklemez.
Risk değiştiriciler
Genetik olarak duyarlı bir bireyin çölyak hastalığı geliştirip geliştirmeyeceğini neyin belirlediğine dair çeşitli teoriler vardır. Ana teoriler arasında ameliyat, hamilelik, enfeksiyon ve duygusal stres yer alır.
Bebeğin hayatının erken döneminde glüten yemesi çölyak hastalığı riskini artırmıyor gibi görünse de, 6 ay sonra glüten tüketilmesi bunu artırabilir. Anne sütüyle beslenmenin riski azaltıp azaltmadığına dair belirsizlik var. Glüten içeren tahılların diyete girmesine kadar emzirmenin uzatılması, bebeklik döneminde çölyak hastalığına yakalanma riskinin% 50 azalmasıyla ilişkili görünmektedir; bunun yetişkinliğe de devam edip etmediği açık değildir. Bu faktörler sadece başlangıç zamanını etkileyebilir.
Patofizyoloji;
Çölyak hastalığı, hem hastalığa birden fazla genetik faktör neden olabileceğinden hem de hastalığın bir kişide ortaya çıkması için birden fazla faktörün gerekli olduğu açısından çok faktörlü görünmektedir.
Çölyak hastalığı olan hemen hemen tüm insanlar (% 95) ya varyant HLA-DQ2 alleline ya da (daha az yaygın olarak) HLA-DQ8 alleline sahiptir. Bununla birlikte, çölyak hastalığı olmayan kişilerin yaklaşık% 20-30'u da bu allellerden birini miras almıştır. Bu, çölyak hastalığının gelişmesi için ek faktörlerin gerekli olduğunu göstermektedir; yani, predispozan HLA risk aleli gereklidir ancak çölyak hastalığı geliştirmek için yeterli değildir. Ayrıca, çölyak hastalığı geliştiren kişilerin yaklaşık% 5'inde tipik HLA-DQ2 veya HLA-DQ8 allelleri yoktur (aşağıya bakınız).
GENETIK
Çölyak hastalarının büyük çoğunluğu HLA-DQ proteininin iki türünden birine sahiptir. HLA-DQ, MHC sınıf II antijen sunan reseptör (aynı zamanda insan lökosit antijeni olarak da adlandırılır) sisteminin bir parçasıdır ve bağışıklık sisteminin amaçları doğrultusunda hücreleri öz ve öz olmayanlar arasında ayırır. HLA-DQ proteininin iki alt birimi, kromozom 6'nın kısa kolunda bulunan HLA-DQA1 ve HLA-DQB1 genleri tarafından kodlanır.
Yedi HLA-DQ varyantı vardır (DQ2 ve DQ4 – DQ9). Çölyak hastalarının% 95'inden fazlası, ailelerden miras kalan DQ2 veya DQ8 izoformuna sahiptir. Bu genlerin çölyak hastalığı riskinde bir artış üretmesinin nedeni, bu genler tarafından oluşturulan reseptörlerin, gliadin peptidlerine antijen sunan reseptörün diğer formlarından daha sıkı bağlanmasıdır. Bu nedenle, reseptörün bu formlarının T lenfositlerini aktive etme ve otoimmün süreci başlatma olasılığı daha yüksektir.
Çölyak hastalarının çoğu, DQ2.5 haplotipi olarak adlandırılan iki genli bir HLA-DQ2 haplotipi taşır. Bu haplotip, iki alt birim olan DQ α5 ve DQ β2'yi kodlayan iki bitişik gen allelinden, DQA1 * 0501 ve DQB1 * 0201'den oluşur. Çoğu kişide, bu DQ2.5 izoformu, ebeveynlerden miras alınan iki kromozom 6'dan biri tarafından kodlanır (DQ2.5cis). Çölyak hastalarının çoğu, bu DQ2.5 haplotipinin yalnızca bir kopyasını miras alırken, bazıları onu her iki ebeveynden miras alır; ikincisi özellikle çölyak hastalığı riski altındadır ve ciddi komplikasyonlara daha duyarlıdır.
Bazı bireyler DQ2.5'i bir ebeveynden ve haplotipin ek bir bölümünü (ya DQB1 * 02 ya da DQA1 * 05) diğer ebeveynden miras alır, bu da riski artırır. Daha az yaygın olarak, bazı bireyler DQA1 * 05 alelini bir ebeveynden ve DQB1 * 02'yi diğer ebeveynden miras alır (DQ2.5trans) (trans haplotip ilişkisi olarak adlandırılır) ve bu bireyler çölyak hastalığı için benzer risk altındadır. DQ2.5 taşıyan tek bir kromozom 6'dır, ancak bu durumda hastalık ailesel olma eğilimindedir. DQ2.5 (cis veya trans) veya DQ8 (haplotip DQA1 * 03: DQB1 * 0302 ile kodlanan) içermeyen Avrupa koeliaklarının% 6'sı arasında,% 4'ünde DQ2.2 izoformu ve kalan% 2'si eksik DQ2 veya DQ8.
Bu genlerin sıklığı coğrafi olarak değişir. DQ2.5, Kuzey ve Batı Avrupa halklarında (en yüksek sıklıklara sahip Bask Ülkesi ve İrlanda) ve Afrika'nın bazı kısımlarında yüksek sıklığa sahiptir ve Hindistan'daki hastalıkla ilişkilidir, ancak Batı Pasifik sınırının bazı kısımlarında bulunmaz. DQ8, DQ2.5'ten daha geniş bir küresel dağıtıma sahiptir ve özellikle Güney ve Orta Amerika'da yaygındır; Belirli Amerikan popülasyonlarındaki bireylerin% 90'a kadarı DQ8 taşır ve bu nedenle çölyak fenotipini gösterebilir.
Çölyak hastalığında başka genetik faktörler defalarca bildirilmiştir; bununla birlikte, hastalığa katılım değişken coğrafi tanıma sahiptir. Yalnızca HLA-DQ lokusları, küresel popülasyon üzerinde tutarlı bir katılım gösterir. Tespit edilen lokusların birçoğunun diğer otoimmün hastalıklarla ilişkili olduğu bulunmuştur. Bir lokus, LPP veya lipom-tercih edilen ortak gen, hücre dışı matrisin hücre yüzeyine yapışmasında rol oynar ve küçük bir varyant (SNP = rs1464510) hastalık riskini yaklaşık% 30 arttırır. Bu gen, Avrupa ve ABD'nin geniş bir bölgesinden alınan örneklerde çölyak hastalığıyla (p <10−39) güçlü bir şekilde ilişkilidir.
Modern popülasyonda çölyak hastalığı genotiplerinin prevalansı tam olarak anlaşılamamıştır. Hastalığın özellikleri ve görünürdeki güçlü kalıtım özelliği göz önüne alındığında, normalde genotiplerin negatif seçime uğraması ve tarımın en uzun süre uygulandığı toplumlarda bulunmaması beklenir (benzer bir durum olan Laktoz intoleransı ile karşılaştırın. negatif olarak o kadar güçlü seçildi ki, ata popülasyonlarında prevalansı ~% 100'den bazı Avrupa ülkelerinde% 5'in altına düştü). Bu beklenti ilk olarak Simoons (1981) tarafından önerildi. Ancak şimdiye kadar durumun böyle olmadığı aşikârdır; tersine çölyak hastalığı genotiplerinde pozitif seleksiyon olduğuna dair kanıtlar vardır. Bazılarının bakteriyel enfeksiyonlara karşı koruma sağlayarak faydalı olabileceğinden şüpheleniliyor.
Prolaminler
Çölyak hastalığında bağışıklık reaksiyonundan sorumlu gıdalardaki proteinlerin çoğu prolaminlerdir. Bunlar alkollerde çözünen ve bağırsaktaki proteazlara ve peptidazlara dirençli, prolin (prol-) ve glutamin (-amin) açısından zengin depolama proteinleridir. Prolaminler, farklı fakat ilişkili prolaminlere sahip farklı tahıllara sahip tahıl tanelerinde bulunur: buğday (gliadin), arpa (hordein), çavdar (secalin) ve yulaf (avenin). Α-gliadin'in bir bölgesi, hücreler arasındaki sızdırmazlık maddesi çevresinde daha büyük moleküllere izin vermek için bağırsağın membran hücrelerini, enterositlerini uyarır. Sıkı bağlantıların bozulması, üç amino asitten daha büyük peptitlerin bağırsak astarına girmesine izin verir.
Membran sızıntısı, iki düzeyde bağışıklık tepkisini uyaran gliadin peptitlerine izin verir: doğuştan gelen tepki ve uyarlanabilir (T yardımcı hücre aracılı) tepki. Α-gliadin'den proteaza dirençli bir peptit, lenfositleri uyaran ve interlökin-15'in salınmasıyla sonuçlanan bir bölge içerir. Gliadine doğuştan gelen bu yanıt, enflamatuar hücreleri çeken ve enflamatuar kimyasalların salınımını artıran bağışıklık sistemi sinyaliyle sonuçlanır. Gliadine karşı en güçlü ve en yaygın adaptif yanıt, uzunluk olarak 33 amino asitlik bir a2-gliadin fragmanına yöneliktir.
33mer'e yanıt, DQ2 izoformuna sahip çoğu çölyak hastasında görülür. Bu peptid, bağırsak transglütaminaz tarafından değiştirildiğinde, yüksek yoğunlukta üst üste binen T hücresi epitoplarına sahiptir. Bu, DQ2 izoformunun T hücreleri tarafından tanındığında peptide bağlanma ve bağlı kalma olasılığını artırır. Buğdayın içindeki gliadin, bu ailenin en iyi anlaşılan üyesidir, ancak diğer prolaminler mevcuttur ve hordein (arpadan), sekalin (çavdardan) ve avenin (yulaftan) çölyak hastalığına katkıda bulunabilir. Çölyak hastalığı olan kişilerde avenin toksisitesi, yulaf çeşitleri arasında değişen prolamin genleri, protein amino asit dizileri ve toksik prolaminlerin immünoreaktiviteleri nedeniyle tüketilen yulaf çeşidine bağlıdır.
Doku transglutaminaz
Enzim doku transglutaminazına (tTG) karşı anti-transglutaminaz antikorları, klasik semptomları ve tam villöz atrofisi olan kişilerin çoğunun kanında bulunur, ancak kısmi villöz atrofili vakaların yalnızca% 70'inde ve minör vakaların% 30'unda bulunur. mukozal lezyonlar. Doku transglütaminaz, glüten peptitlerini bağışıklık sistemini daha etkili bir şekilde uyarabilecek bir forma dönüştürür. Bu peptitler tTG tarafından iki şekilde modifiye edilir: deamidasyon veya transamidasyon.
Deamidasyon, bir glutamat kalıntısının, bir glutamin yan zincirinin epsilon-amino grubunun bölünmesiyle oluşturulduğu reaksiyondur. Deamidasyondan üç kat daha sık meydana gelen transamidasyon, gliadin peptidinden bir glutamin kalıntısının, transglütaminaz tarafından katalize edilen bir reaksiyonda tTg'nin bir lizin kalıntısına çapraz bağlanmasıdır. Çapraz bağlanma, enzimin aktif bölgesi içinde veya dışında meydana gelebilir. İkinci durum, gliadin ve tTg arasında kalıcı olarak kovalent olarak bağlanmış bir kompleks verir. Bu, tTg'ye karşı otoantikorların geliştiği birincil bağışıklık tepkisini tetiklediğine inanılan yeni epitopların oluşumuyla sonuçlanır.
Çölyak hastalığı şüphesi olan kişilerden saklanan biyopsiler, subklinik çölyaklarda otoantikor birikimlerinin klinik hastalıktan önce tespit edildiğini ortaya çıkarmıştır. Bu birikintiler aynı zamanda diğer otoimmün hastalıklar, anemi veya emilim bozukluğu fenomeni olan kişilerde normal popülasyona göre çok daha yüksek oranda bulunur. TTG'ye karşı antikorların (EMA) endomysial bileşenlerinin hücre yüzeyi transglutaminaza doğru yönlendirildiğine inanılmaktadır ve bu antikorlar, bir çölyak hastalığı teşhisinin doğrulanmasında hala kullanılmaktadır. Bununla birlikte, 2006 yılında yapılan bir çalışma, çölyak hastası olan EMA negatif kişilerin, daha şiddetli karın semptomları ve otoimmün hastalık dahil olmak üzere daha düşük "atipik" semptom sıklığı olan yaşlı erkekler olma eğiliminde olduğunu gösterdi. Bu çalışmada, anti-tTG antikor birikintileri, villöz yıkımın ciddiyeti ile ilişkili değildi. Bu bulgular, gliadinin doğuştan gelen bir yanıt bileşenine sahip olduğunu gösteren son çalışmalarla birleştiğinde, gliadinin çölyak hastalığının birincil belirtilerinden daha sorumlu olabileceğini, buna karşılık tTG'nin alerjik yanıtlar ve ikincil otoimmün hastalıklar gibi ikincil etkilerde daha büyük bir faktör olduğunu düşündürmektedir. Çölyaklı kişilerin büyük bir kısmında anti-tTG antikorları ayrıca VP7 adı verilen bir rotavirüs proteinini de tanır. Bu antikorlar, monosit proliferasyonunu uyarır ve rotavirüs enfeksiyonu, immün hücre proliferasyonu kaskadındaki bazı erken adımları açıklayabilir.
Aslında, bağırsaktaki rotavirüs hasarıyla ilgili daha önceki çalışmalar, bunun villöz bir atrofiye neden olduğunu gösterdi. Bu, viral proteinlerin ilk düzleşmede yer alabileceğini ve kendi kendine çapraz reaktif anti-VP7 üretimini uyarabileceğini göstermektedir. VP7'ye yönelik antikorlar, gliadin aracılı tTG sunumu ikinci bir çapraz reaktif antikor kaynağı sağlayana kadar iyileşmeyi yavaşlatabilir.
Diğer bağırsak bozuklukları, Candida'nın neden olduğu lezyonlar dahil çölyak hastalığına benzeyen biyopsiye sahip olabilir.
Villöz atrofi ve malabsorpsiyon
T hücrelerinin aracılık ettiği enflamatuar süreç, ince bağırsak mukozal astarının yapısının ve işlevinin bozulmasına yol açar ve vücudun besinleri, mineralleri ve yağda çözünen A, D, E vitaminlerini ve yağda çözünen vitaminleri absorbe etme yeteneğini bozarak malabsorbsiyona neden olur. Yiyeceklerden K. Laktoz intoleransı, bağırsak yüzeyinin azalması ve laktaz üretiminin azalması nedeniyle mevcut olabilir, ancak tipik olarak durum tedavi edildikten sonra düzelir.
Bu doku hasarının alternatif nedenleri öne sürülmüştür ve interlökin 15 salınımı ve daha kısa bir glüten peptidi tarafından doğal bağışıklık sisteminin aktivasyonunu içerir (p31-43 / 49). Bu, epiteldeki lenfositler tarafından enterositlerin öldürülmesini tetikleyecektir. Biyopside görülen villöz atrofi ayrıca tropikal sprue, giardiasis ve radyasyon enteriti gibi ilgisiz nedenlere bağlı olabilir. Pozitif seroloji ve tipik biyopsi çölyak hastalığını oldukça düşündürürken, diyete yanıt eksikliği bu alternatif tanıların dikkate alınmasını gerektirebilir.
Teşhis;
Teşhis genellikle zordur ve 2019 itibariyle, doktorlar arasında çölyak hastalığının sunumlarının değişkenliği ve teşhis kriterleri hakkında farkındalık eksikliği devam etmektedir, öyle ki çoğu vakaya büyük gecikmelerle teşhis konulmaktadır. Semptomların başlangıcından itibaren tanı konması 12 yıla kadar sürebilir ve çoğu ülkede etkilenenlerin çoğu asla almaz.
Kullanılabilecek birkaç test vardır. Semptomların seviyesi testlerin sırasını belirleyebilir, ancak kişi zaten glütensiz bir diyet yiyorsa tüm testler yararlılığını yitirir. Glüten diyetten çıkarıldıktan sonraki haftalar içinde bağırsak hasarı iyileşmeye başlar ve antikor seviyeleri aylar içinde düşer. Glütensiz bir diyete zaten başlamış olanlar için, araştırmaları tekrarlamadan önce 6 hafta boyunca günde bir öğünde bazı glüten içeren yiyeceklerle yeniden sorgulama yapmak gerekli olabilir.
Kan testleri
Serolojik kan testleri, çölyak hastalığı tanısı koymak için gereken ilk basamak araştırmadır. Duyarlılığı histolojik lezyonların derecesi ile ilişkilidir. İnce bağırsakta küçük hasar olan kişiler seronegatif bulgulara sahip olabilir, bu nedenle çölyak hastalığı olan birçok hasta sıklıkla gözden kaçar. Villöz atrofisi olan hastalarda immünoglobulin A (IgA) tipi anti-endomysial (EMA) antikorları çölyak hastalığını sırasıyla% 90 ve% 99 duyarlılık ve özgüllükle tespit edebilir. [87] Anti-transglütaminaz antikorları (anti-tTG) için serolojinin başlangıçta daha yüksek bir duyarlılığa (% 99) ve özgüllüğe (>% 90) sahip olduğu bildirilmiştir. Bununla birlikte, şimdi anti-endomysial antikora benzer özelliklere sahip olduğu düşünülmektedir. Hem anti-transglutaminaz hem de anti-endomysial antikorlar, klasik semptomları ve tam villöz atrofisi olan kişileri teşhis etmek için yüksek hassasiyete sahiptir, ancak bunlar sadece kısmi villöz atrofi olan vakaların% 30-89'unda ve olanların% 50'den azında bulunur. normal villuslu küçük mukozal lezyonlar (duodenal lenfositoz) var.
Doku transglütaminaz, glüten peptitlerini bağışıklık sistemini daha etkili bir şekilde uyarabilecek bir forma dönüştürür. Bu peptitler tTG tarafından iki şekilde modifiye edilir: deamidasyon veya transamidasyon. Modern anti-tTG tahlilleri, bir antijen olarak bir insan rekombinant proteinine dayanır. tTG testi, gerçekleştirmesi daha kolay bir test olduğu için önce yapılmalıdır. TTG testinde şüpheli bir sonucu anti-endomysial antikorlar izlemelidir.
IgA eksikliği olan çölyak hastaları bu testlerin bağlı olduğu antikorları üretemeyebileceğinden ("yanlış negatif"), toplam serum IgA düzeyinin paralel olarak kontrol edilmesini önermektedir. Bu insanlarda, transglütaminaza (IgG-tTG) karşı IgG antikorları tanısal olabilir.
Tüm bu antikorlar negatif ise anti-DGP antikorları (deamide gliadin peptidlerine karşı antikorlar) belirlenmelidir. IgG sınıfı anti-DGP antikorları, IgA eksikliği olan kişilerde faydalı olabilir. İki yaşından küçük çocuklarda anti-DGP antikorları, anti-endomysial ve anti-transglutaminase antikor testlerinden daha iyi performans gösterir.
Çölyak hastalığı teşhisinin başlıca sonuçları nedeniyle, profesyonel kılavuzlar, pozitif bir kan testinin hala bir endoskopi / gastroskopi ve biyopsi ile takip edilmesini önermektedir. Negatif bir seroloji testinin ardından, klinik şüphe hala yüksekse, endoskopi ve duodenal biyopsi önerisi gelebilir.
Tarihsel olarak diğer üç antikor ölçüldü: anti-retikülin (ARA), anti-gliadin (AGA) ve anti-endomysial (EMA) antikorları. Ancak ARA testi, rutin teşhis kullanımı için yeterince doğru değildir. Anti-gliadin beş yaşın altındaki çocuklarda diğer testlerden biraz daha iyi performans gösterdiği için, küçük çocuklarda seroloji güvenilmez olabilir. Seroloji testleri, dolaylı immünofloresana (retikulin, gliadin ve endomysium) veya ELISA'ya (gliadin veya doku transglutaminaz, tTG) dayanır.
Anti-Saccharomyces cerevisiae antikorları gibi diğer antikorlar çölyak hastalığı olan bazı kişilerde ortaya çıkarken diğer otoimmün bozukluklarda ve kan bağışı yapanların yaklaşık% 5'inde ortaya çıkar.
Tanı net değilse antikor testi HLA testi ile birleştirilebilir. TGA ve EMA testi en hassas serum antikor testleridir, ancak negatif bir HLA-DQ tipi çölyak hastalığı tanısını dışladığından, HLA-DQ2 veya DQ8 için de testler duyarlılığı ve negatif prediktif değerleri maksimize eder. Bununla birlikte, çölyak hastalığını dışlamak için HLA tiplemesinin yaygın kullanımı şu anda önerilmemektedir.
ENDOSKOPi
Duodenumdan (duodenal ampulün ötesinde) veya jejunumdan biyopsi ile bir üst endoskopi, duodenumdan çok sayıda örnek (dört ila sekiz) elde etmek için gerçekleştirilir. Tüm alanlar eşit şekilde etkilenmeyebilir; Biyopsiler sağlıklı bağırsak dokusundan alınırsa, sonuç yanlış negatif olur. Aynı biyoptik parçada bile, farklı derecelerde hasar mevcut olabilir.
Çölyak hastalığı olan çoğu insanın, biyopsiler incelenmeden önce endoskopide normal görünen ince bir bağırsağı vardır. Bununla birlikte, beş bulgu çölyak hastalığı için yüksek bir özgüllükle ilişkilendirilmiştir: ince bağırsak kıvrımlarının taranması (resimde), kıvrımlarda yetersizlik, mukozaya mozaik bir model ("çatlak çamur" görünümü olarak tanımlanmıştır), belirgin submukoza kan damarları ve mukozaya nodüler bir model.
Avrupa kılavuzları, çölyak hastalığı ile uyumlu semptomları olan çocuklarda ve ergenlerde, anti-tTG antikor titreleri çok yüksekse (normalin üst sınırının 10 katı) tanının bağırsak biyopsisine gerek kalmadan yapılabileceğini öne sürmektedir.
1970'lere kadar bir emme cihazına takılan metal kapsüller kullanılarak biyopsiler elde ediliyordu. Kapsül yutuldu ve ince bağırsağa geçmesine izin verildi. Konumunun röntgenle doğrulanmasından sonra, bağırsak duvarının bir kısmını kapsül içinde toplamak için emme uygulandı. Genellikle kullanılan kapsül sistemleri Watson kapsülü ve Crosby – Kugler kapsülüdür. Bu yöntemin yerini büyük ölçüde, daha yüksek hassasiyet ve daha düşük hata sıklığı taşıyan fiber optik endoskopi almıştır.
Kapsül endoskopi (CE) çölyak hastalığında gözlemlenen tipik mukozal değişikliklerin tanımlanmasına izin verir, ancak normal endoskopi ve histolojiye kıyasla daha düşük bir duyarlılığa sahiptir. Bu nedenle CE, çölyak hastalığı için birincil tanı aracı değildir. Ancak CE, refrakter veya komplike çölyak hastalığında T hücreli lenfoma, ülseratif jejunoileit ve adenokarsinomu teşhis etmek için kullanılabilir.
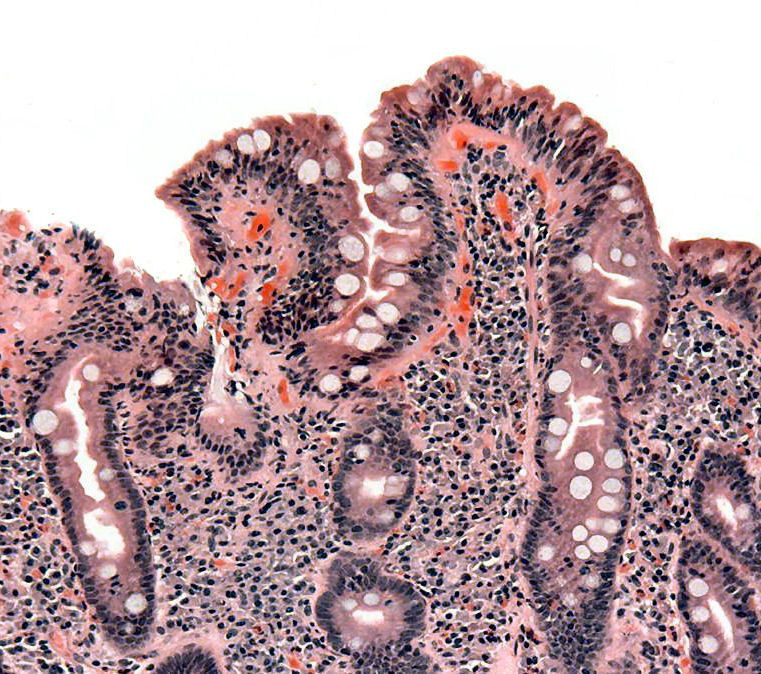
Patoloji
İnce bağırsakta çölyak hastalığının klasik patoloji değişiklikleri "Marsh sınıflandırması" ile kategorize edilir:
Marsh evre 0: normal mukoza
Marsh evre 1: epitelyal lenfositlerin (IEL) sayısında artış, genellikle 100 enterositte 20'yi aşıyor
Marsh evre 2: Lieberkühn kriptalarının çoğalması
Marsh evre 3: kısmi veya tam villöz atrofi ve kript hipertrofisi [99]
Marsh evre 4: ince bağırsak yapısının hipoplazisi
1992'de tanıtılan Marsh'ın sınıflandırması, daha sonra 1999'da, önceki aşama 3'ün üç alt bölüme ayrıldığı altı aşamaya değiştirildi. Daha ileri çalışmalar, bu sistemin her zaman güvenilir olmadığını ve çölyak hastalığında gözlenen değişikliklerin üç aşamadan birinde tanımlanabileceğini göstermiştir:
Normal villöz görünümlü temsil eden lenfositik infiltrasyon;
Kısmi villöz atrofiyi tarif eden B1; ve
B2 tam villöz atrofiyi tanımlamaktadır.
Glüten diyetten çıkarıldıktan sonra değişiklikler klasik olarak iyileşir veya tersine döner. Bununla birlikte, çoğu kılavuz diyetteki semptomlarda herhangi bir iyileşme olmadığı sürece biyopsi tekrarlanmasını önermemektedir. Bazı durumlarda, teşhisi doğrulamak veya çürütmek için kasıtlı bir glüten testi ve ardından biyopsi yapılabilir. Tehditten sonra normal bir biyopsi ve normal seroloji, tanının yanlış olabileceğini gösterir.
Tedavi edilmeyen çölyak hastalığında, villöz atrofi üç yaşından küçük çocuklarda daha yaygındır, ancak daha büyük çocuklarda ve yetişkinlerde normal bağırsak villusuyla birlikte küçük bağırsak lezyonları (duodenal lenfositoz) bulmak yaygındır.
Diğer teşhis testleri
Tanı anında, demir eksikliği (tam kan sayımı ve demir çalışmaları ile), folik asit ve vitamin B12 eksikliği ve hipokalsemi (düşük kalsiyum seviyeleri, genellikle D vitamini seviyelerinin azalmasına bağlı olarak) gibi komplikasyonları belirlemek için daha ileri araştırmalar yapılabilir. . Çölyak hastalığı olan kişilerde daha sık görülen hipotiroidizmi belirlemek için kan testleri sırasında tiroid fonksiyon testleri istenebilir.
Çölyak hastalığı olan kişilerde hafif ve ciddi ölçüde azalmış kemik mineral yoğunluğu olan osteopeni ve osteoporoz sıklıkla mevcuttur ve riski belirlemek için çift enerjili X-ışını absorpsiyometrisi (DXA) taraması gibi tanı sırasında kemik yoğunluğunu ölçmek için araştırmalar yapılabilir kırık ve kemik koruyucu ilaç ihtiyacı.
Glutenden çekilme
Kan antikor testleri, biyopsiler ve genetik testler genellikle net bir teşhis sağlasa da, bazen tanıyı desteklemek için glütensiz diyette glüten yoksunluğuna yanıt verilmesi gerekir. Şu anda, çölyak hastalığı ile uyumlu bağırsak lezyonları ve glütensiz diyete olumlu yanıt veren hastalarda teşhisi doğrulamak için glüten yüklemesine artık gerek yoktur. Bununla birlikte, bazı durumlarda, sonraki bir biyopsi ile glüten yüklemesi, örneğin çölyak hastalığı için yüksek şüpheli, biyopsi onayı olmayan, negatif kan antikorları olan ve halihazırda glüten tedavisi gören kişilerde teşhisi desteklemek için yararlı olabilir ücretsiz diyet. Glüten tehdidi, 5 yaşından önce ve pubertal büyüme sırasında önerilmez. Çölyak dışı glüten duyarlılığının alternatif tanısı, glüten duyarlılığının yalnızca semptomatik kanıtlarının olduğu durumlarda yapılabilir. Çölyak dışı glüten duyarlılığı olan kişilerin gastrointestinal ve ekstraintestinal semptomları çölyak hastalığına benzer olabilir ve çölyak hastalığı ve buğday alerjisi makul ölçüde dışlandıktan sonra glüten diyetten çıkarıldığında düzelir.
İnsanların% 30 kadarı, glütensiz bir diyete başladıktan sonra genellikle semptomları yaşamaya veya yeniden geliştirmeye devam eder. Çölyak hastalığı olan bir kişide yanıt verilememesi, küçük miktarlarda glütenin istemli veya kasıtsız olarak sürekli alınmasından veya ince bağırsak gibi diğer yaygın ilişkili durumlardan kaynaklanabileceğinden, semptomatik yanıtın dikkatli bir şekilde yorumlanması gerekir. bakteri aşırı çoğalması (SIBO), laktoz intoleransı, fruktoz, sukroz ve sorbitol malabsorpsiyonu, ekzokrin pankreas yetmezliği ve mikroskobik kolit. Tedavi edilmeyen çölyak hastalığında bunlar genellikle bağırsak hasarından kaynaklanan geçici durumlardır. Normalde glütensiz bir diyete başladıktan birkaç ay sonra geri dönerler veya iyileşirler, ancak pankreas enzimleriyle takviye, laktoz, fruktoz, sukroz veya sorbitol içeren gıdaların diyet kısıtlamaları veya ilişkili durumlarda oral antibiyotiklerle tedavi gibi geçici müdahalelere ihtiyaç duyabilirler. bakteriyel aşırı büyüme. Glüten yoksunluğuna ek olarak, bazı kişilerin düşük FODMAP diyetine uymaları veya genellikle koruyucu ve katkı maddeleri (sülfitler, glutamatlar, nitratlar ve benzoatlar gibi) açısından zengin olan ticari glütensiz ürünlerin tüketiminden kaçınmaları gerekir ve bir rolü olabilir. fonksiyonel gastrointestinal semptomların tetiklenmesinde.
Tarama;
Taramanın yararları konusunda tartışmalar var. 2017 itibariyle, Amerika Birleşik Devletleri Önleyici Hizmetler Görev Gücü, semptomları olmayanlar arasında bir tavsiyede bulunmak için yetersiz kanıt buldu. Birleşik Krallık'ta, Ulusal Sağlık ve Klinik Mükemmellik Enstitüsü (NICE), sürekli yorgunluk, abdominal veya gastrointestinal semptomlar, yavaşlayan büyüme, açıklanamayan kiloları olan kişilerde, hastalığı önceden doğrulanmış olanların birinci derece akrabalarında çölyak hastalığı için test yapılmasını önermektedir. demir kaybı, B12 vitamini veya folat eksikliği, şiddetli ağız ülserleri ve tip 1 diyabet, otoimmün tiroid hastalığı ve yeni teşhis edilmiş kronik yorgunluk sendromu ve irritabl bağırsak sendromu teşhisi. Dermatitis herpetiformis, diğer tavsiyelere dahil edilmiştir. NICE ayrıca metabolik kemik hastalığı (azalmış kemik mineral yoğunluğu veya osteomalazi), açıklanamayan nörolojik bozukluklar (periferik nöropati ve ataksi gibi), doğurganlık sorunları veya tekrarlayan düşük, nedeni bilinmeyen sürekli yükselen karaciğer enzimleri olan kişilerde çölyak hastalığı için serolojik test yapılmasını önermektedir, diş minesi kusurları ve Down sendromu veya Turner sendromu teşhisi ile.
Bazı kanıtlar, erken teşhisin osteoporoz, anemi ve belirli kanser türleri, nörolojik bozukluklar, kardiyovasküler hastalıklar ve üreme sorunları gibi sağlık komplikasyonları geliştirme riskini azaltabileceğini bulmuştur. Bu nedenle belirli sağlık sorunları olan kişilerde tarama yapılmasını önerirler.
Seroloji, bir tarama önlemi olarak önerilmiştir, çünkü antikorların varlığı, önceden teşhis edilmemiş çölyak hastalığı vakalarını tespit eder ve bu kişilerde komplikasyonlarını önler. Bununla birlikte, serolojik testler yalnızca total villöz atrofisi olan kişilerde yüksek duyarlılığa sahiptir ve kısmi villöz atrofi veya minör bağırsak lezyonları olan vakaları tespit etme yeteneği çok düşüktür. Çölyak hastalığı testi, yaygın olarak ilişkili rahatsızlıkları olanlara önerilebilir.
Tedavi;
Diyet
Ana madde: Glutensiz diyet
Şu anda, tek etkili tedavi ömür boyu glutensiz beslenmedir. Glüten mevcut olduğunda vücudun bağırsağa saldırmasını engelleyen veya engelleyen hiçbir ilaç yoktur. Diyete sıkı sıkıya bağlı kalmak, bağırsakların iyileşmesine yardımcı olur, çoğu durumda tüm semptomların çözülmesine yol açar ve diyetin ne kadar erken başladığına bağlı olarak, osteoporoz ve bağırsak kanseri riskini ve bazı durumlarda kısırlığı da ortadan kaldırabilir. Diyet külfetli olabilir; diyete uyulmaması nüksetmeye neden olabilir.
Diyetisyen girdisi genellikle kişinin hangi yiyeceklerin glüten içerdiğini, hangi yiyeceklerin güvenli olduğunu ve kısıtlamalara rağmen nasıl dengeli besleneceğini bilmesini sağlamak için istenir. Pek çok ülkede, glutensiz ürünler reçeteyle satılır ve sağlık sigortası planları tarafından geri ödenebilir. Glutensiz ürünler genellikle daha pahalıdır ve glüten içeren gıdalardan daha zor bulunur. Hazır ürünler genellikle eser miktarda glüten içerdiğinden, bazı çölyak hastaları sıfırdan pişirmeyi gerekli bulabilir.
"Glütensiz" terimi genellikle tam bir yokluktan ziyade sözde zararsız bir glüten düzeyini belirtmek için kullanılır. Glütenin zararsız olduğu kesin düzey belirsiz ve tartışmalıdır. Son zamanlarda yapılan bir sistematik inceleme, geçici olarak, günde 10 mg'dan daha az glüten tüketiminin histolojik anormalliklere neden olma ihtimalinin düşük olduğu sonucuna varmıştır, ancak birkaç güvenilir çalışmanın yapıldığı belirtilmiştir. "Glutensiz" etiketinin düzenlenmesi değişiklik gösterir. Avrupa Birliği'nde, Avrupa Komisyonu 2009 yılında gıda ürünleri için "glütensiz" etiketlerin kullanımını 20 mg / kg'dan az glüten içerenlerle ve "çok düşük glüten" etiketlerinin kullanımını 100'den az olanlar için sınırlayan düzenlemeler yayınladı mg / kg. Amerika Birleşik Devletleri'nde FDA, 2013 yılında gıda ürünleri için "glütensiz" etiketlerin kullanımını 20 ppm'den az glüten içerenlerle sınırlayan düzenlemeler yayınladı. Mevcut uluslararası Codex Alimentarius standardı, "glütensiz" olarak adlandırılan gıdalarda 20 ppm glütene izin vermektedir. Glutensiz Sertifikasyon Organizasyonu (GFCO), Celiac Sprue Association (CSA) ve National Foundation for Celiac Awareness (NFCA) gibi çeşitli kuruluşlar da ürünleri ve şirketleri glütensiz olarak onaylamaktadır.
Glutensiz beslenme, sağlıkla ilişkili yaşam kalitesini iyileştirir ve diyete sıkı sıkıya bağlı kalmak, eksik uyuma göre daha fazla fayda sağlar. Yine de glütensiz beslenme, yaşam kalitesini tamamen normalleştirmez.
Refrakter hastalık
İnsanların% 0,3 ila% 10'u refrakter hastalığa sahiptir; bu, 12 aydan uzun süredir glütene maruz kalmamalarına rağmen, glütensiz diyette kalıcı villöz atrofiye sahip oldukları anlamına gelir. Bununla birlikte, glütene yanlışlıkla maruz kalma, kalıcı villöz atrofinin ana nedenidir ve dirençli hastalık tanısı konmadan önce dışlanmalıdır. Zayıf temel eğitimi olan ve glütensiz beslenmeyi anlayan kişiler genellikle diyete kesinlikle uyduklarına, ancak düzenli hatalar yaptıklarına inanırlar. Ayrıca semptom eksikliği, bağırsak iyileşmesinin güvenilir bir göstergesi değildir.
Villöz atrofinin alternatif nedenleri ortadan kaldırılmışsa, bu senaryoda steroidler veya immünsüpresanlar (azatioprin gibi) düşünülebilir.
Dirençli çölyak hastalığı, bağırsak hasarından kaynaklanan geçici durumların neden olduğu, genellikle ince bağırsakta aşırı bakteri üremesi, laktoz intoleransı gibi glütensiz diyete başladıktan birkaç ay sonra geri dönen veya düzelen glüten çekilmesine rağmen semptomların kalıcılığı ile karıştırılmamalıdır. fruktoz, sukroz ve sorbitol malabsorpsiyonu, ekzokrin pankreas yetmezliği ve diğerleri arasında mikroskobik kolit.
Epidemiyoloji;
Küresel olarak çölyak hastalığı 170 kişide 100'de 1 ila 1'i etkiler. Bununla birlikte, oranlar dünyanın farklı bölgeleri arasında 300'de 1'den 40'da 1'e kadar değişmektedir. Amerika Birleşik Devletleri'nde 1750'de 1'i etkilediği düşünülmektedir (sınırlı sindirim sistemi olan dermatit herpetiformis dahil klinik hastalık olarak tanımlanmıştır). kanal semptomları) 105'te 1 (kan donörlerinde IgA TG varlığı ile tanımlanmıştır). Değişken belirti ve semptomlar nedeniyle, etkilenen kişilerin yaklaşık% 85'inin teşhis edilmediğine inanılmaktadır. Klinik olarak teşhis edilmiş hastalığı olan kişilerin yüzdesi (tanısal testleri gerektiren semptomlar) çeşitli çalışmalarda% 0,05-0,27'dir. Bununla birlikte, Avrupa, Hindistan, Güney Amerika, Avustralasya ve ABD'nin bazı bölgelerinde (seroloji ve biyopsi kullanılarak) yapılan popülasyon çalışmaları, hastalığı olan kişilerin yüzdesinin çocuklarda% 0,33 ile% 1,06 arasında olabileceğini göstermektedir (ancak bir çalışmada% 5,66 yatkın Sahrawi halkının çocukları) ve yetişkinlerde% 0.18-1.2. Gastrointestinal semptomları bildiren birinci basamak popülasyonlarında olanlar arasında çölyak hastalığı oranı yaklaşık% 3'tür. Avustralya'da yaklaşık 70 kişiden 1'i bu hastalığa sahiptir. İran, İsrail, Suriye ve Türkiye'de yetişkin kan bağışçıları arasındaki oran sırasıyla% 0,60,% 0,64,% 1,61 ve% 1,15'tir.
Afrika, Japon ve Çin kökenli insanlara nadiren teşhis konulur; bu, HLA-B8 gibi genetik risk faktörlerinin çok daha düşük bir prevalansını yansıtır. Hint kökenli insanlar, Batı Kafkas soyundan gelenlere benzer bir risk taşıyor gibi görünüyor. Nüfus çalışmaları aynı zamanda coeliac'lerin büyük bir kısmının teşhis edilmediğini de göstermektedir; bu kısmen birçok klinisyenin duruma aşina olmamasından ve ayrıca semptomsuz olabileceğinden kaynaklanmaktadır. Çölyak hastalığı kadınlarda erkeklerden biraz daha yaygındır. ABD'de çok merkezli bir çalışma, risk altında olmayan gruplarda% 0,75'lik bir yaygınlık bulmuş, semptomatik kişilerde% 1,8'e, ikinci derece akrabalarında (büyükanne ve büyükbaba, teyze veya amca, torunlar vb.) çölyak hastalığı olan bir kişi ve birinci derece akrabalarda (kardeşler, ebeveynler veya çocuklar)% 4.5. Bu profil, Avrupa'daki yaygınlığa benzer. Prevalans oranları% 5 ila% 10 arasında değişen çölyak hastalığı için artmış risk altındaki diğer popülasyonlar, Down ve Turner sendromları, tip 1 diyabet ve otoimmün tiroid hastalığı olan bireyleri içerir, bunlara hem hipertiroidizm (aşırı aktif tiroid) hem de hipotiroidizm (yetersiz tiroid) dahildir.
Tarihsel olarak çölyak hastalığının, yaklaşık% 0,02'lik bir prevalansla nadir olduğu düşünülüyordu. Bildirilen vaka sayısındaki son artışların nedeni belirsizdir. En azından kısmen teşhis uygulamasındaki değişikliklerden kaynaklanıyor olabilir. Batı ortamlarında bakteri ve diğer patojenlere daha az maruz kalmaya bağlı olarak yaklaşık 4,5 kat gerçek bir artış olduğu görülüyor. Amerika Birleşik Devletleri'nde, tanı anındaki medyan yaş 38'dir. Çölyak hastalığı olan kişilerin yaklaşık yüzde 20'si 60 yaşından sonra teşhis edilir.
Tarih;
"Çölyak" terimi Yunanca κοιλιακός (koiliakós, "abdominal") kelimesinden gelmektedir ve 19. yüzyılda Kapadokya Aretaeus tarafından hastalığın Antik Yunan tanımı olarak kabul edilen bir tercümede tanıtılmıştır.
İnsanlar tahılları ilk kez Neolitik dönemde (yaklaşık MÖ 9500'den başlayarak) Batı Asya'daki Bereketli Hilal'de yetiştirmeye başladılar ve çölyak hastalığının bu zamandan önce görülmemiş olması muhtemeldir. İkinci yüzyılda aynı bölgede yaşayan Kapadokya Aretaeus, kronik ishal ile birlikte malabsorptif bir sendrom kaydetti ve tüm vücutta güçsüzleşmeye neden oldu. Francis Adams, 1856'da Sydenham Society'de Aretaeus'un çalışmasının bir çevirisini sunduğunda, "Cœliac Affection" (Yunanca κοιλιακός koiliakos'tan çölyak, "abdominal") Batı tıbbının dikkatini çekti. Aretaeus'un çalışmasında anlatılan hastanın mide ağrısı vardı ve körelmiş, soluk, güçsüz ve çalışamayacak durumda. İshal, beyaz, kötü kokulu ve şişkin gevşek dışkı olarak kendini gösterdi ve hastalık inatçı ve periyodik geri dönüşe yatkın oldu. Aretaeus, sorunun midede yiyeceği sindirmek için gerekli olan ısı eksikliği ve sindirim ürünlerini vücuda dağıtma yeteneğinin azalması olduğuna inanıyordu, bu eksik sindirim ishale neden oldu. Bunu, çocukları açıkça dışlayarak, yaşlıların ve daha çok kadınları etkileyen bir rahatsızlığı olarak gördü. Aretaeus'a göre neden bazen ya başka bir kronik hastalık ya da "bol miktarda soğuk su akışı" tüketmekti.
Çocuk doktoru Samuel Gee, 1887'de Londra'daki Great Ormond Street, Sick Children Hastanesi'nde bir konferansta çocuklarda görülen durumun ilk modern tarifini verdi. Gee, hastalık için daha önceki tanımları ve terimleri kabul etti ve Aretaeus ile aynı terimi benimsedi. (Çölyak hastalığı). Algısal olarak şunları söyledi: "Hasta tedavi edilebiliyorsa, diyet yoluyla olmalı." Gee, süte tahammülsüzlüğün çölyak hastaları için bir sorun olduğunu ve çok nişastalı yiyeceklerden kaçınılması gerektiğini fark etti. Ancak, yemesi güvenli olan pirinç, sago, meyve ve sebzeleri yasakladı ve çiğ etin yanı sıra ince dilim kızarmış ekmek önerdi. Gee, "her gün bir çeyrek en iyi Hollanda midyesinden beslenen" bir çocukla özel başarının altını çizdi. Ancak çocuk bu diyeti bir sezondan fazla kaldıramadı.
Amerikalı bir doktor olan Christian Archibald Herter, 1908'de çölyak hastalığı olan çocuklar üzerine "bağırsak çocukçuluğu" adını verdiği bir kitap yazdı. Büyümelerinin geciktiğini ve yağın karbonhidrattan daha iyi tolere edildiğini belirtti. Gee-Herter hastalığı, bazen her iki katkıyı da kabul etmek için kullanılmıştır. Amerikalı bir çocuk doktoru olan Sidney V. Haas, 1924'te muz diyetinin olumlu etkilerini bildirdi. Bu diyet, çölyak hastalığının gerçek nedeni belirlenene kadar revaçta kaldı.
Karbonhidratlar için bir rol olduğundan şüphelenilirken, buğdayla bağlantı 1940'lara kadar Hollandalı çocuk doktoru Dr Willem Karel Dicke tarafından kurulmamıştı. 1944'teki Hollanda kıtlığı sırasında (ki bu dönemde un kıttı) hastalarının klinik iyileşmesi, keşfine katkıda bulunmuş olabilir. Dicke, ekmek kıtlığının çölyak hastalığından etkilenen çocuklar arasında ölüm oranının% 35'ten büyük ölçüde sıfıra düşmesine neden olduğunu fark etti. Ayrıca, çatışmadan sonra buğdayın tekrar kullanılabilir hale gelmesiyle ölüm oranının önceki seviyelere yükseldiğini bildirdi. Buğdayın glüten bileşeniyle bağlantı 1952'de Birmingham, İngiltere'den bir ekip tarafından yapıldı. Villöz atrofi, 1954'te İngiliz doktor John W. Paulley tarafından ameliyat sırasında alınan örneklerde tanımlandı. Bu, endoskopi ile alınan biyopsi örneklerinin yolunu açtı.
1960'lar boyunca çölyak hastalığının diğer özellikleri aydınlatıldı. Kalıtsal karakteri 1965'te tanındı. 1966'da dermatitis herpetiformis, glüten duyarlılığı ile ilişkilendirildi.
Sosyal ve kültür;
Mayıs ayı, çeşitli çölyak kuruluşları tarafından "Çölyak Farkındalık Ayı" olarak belirlendi.
Hıristiyan kiliseleri ve Efkaristiya
Genel olarak konuşursak, Hristiyanların çeşitli mezhepleri, buğday ekmeğinden bir gofret veya küçük bir parça kutsal ekmeğin kutsanıp sonra yenildiği bir Efkaristiya'yı kutlar. Tipik bir gofret yaklaşık yarım gram ağırlığındadır. Buğday unu yaklaşık% 10 ila 13 glüten içerir, bu nedenle tek bir komünyon gofretinde 50 mg'dan fazla glüten bulunabilir; bu, özellikle her gün tüketilirse çölyak hastalarına zarar veren bir miktardır (bkz.
Birçok Hristiyan kilisesi, iletişimcilerine genellikle pirinç bazlı kraker veya glütensiz ekmek şeklinde glütensiz alternatifler sunar. Bunlar arasında Birleşik Metodist, Hıristiyan Reformcu, Piskoposluk, Anglikan Kilisesi (İngiltere Kilisesi, İngiltere) ve Lutheran bulunmaktadır. Katolikler yalnızca Kadeh'ten yiyecek alabilir veya glüteni azaltılmış konakçı isteyebilir; ancak glütensiz olanlar hala buğday ekmeği olarak kabul edilmez ve bu nedenle geçersiz bir madde.
Roma Katolik konumu
Roma Katolik doktrini, geçerli bir Eucharist için Ayin'de kullanılacak ekmeğin buğdaydan yapılması gerektiğini belirtir. Düşük glütenli konakçılar Katolik Kilisesi'nin tüm gereksinimlerini karşılar, ancak tamamen glütensiz değildirler. Pirinç gofretleri kullanma talepleri reddedildi.
Sorun rahipler için daha karmaşık. Bir ayin olarak, bir rahip, Ayinin kurbanının doluluğu için, kesinlikle her iki türe bağlı olarak kabul edilmelidir. 24 Temmuz 2003'te, İnanç Doktrini Cemaati, "Evkaristinin bir rahibin hayatındaki kutlamalarının önemi göz önünde bulundurulduğunda, glüten ya da glüten yiyemeyen adayları Kutsal Emirlere kabul etmeden önce büyük bir dikkatle ilerlemelisiniz. ciddi zarar vermeden alkol. "
Ocak 2004 itibariyle, son derece düşük glutenli Kilise onaylı ev sahipleri Amerika Birleşik Devletleri, İtalya ve Avustralya'da kullanıma sunuldu. Temmuz 2017 itibariyle, Vatikan hala Kutsal Komünyon için glütensiz ekmek kullanımını yasakladı.
Fısıh
Yahudi Pesah bayramı (Fısıh), buğday, arpa, kılçıksız buğday, yulaf veya çavdardan sıkı kontrollü bir şekilde yapılan mayasız ekmek olan matzo yeme zorunluluğuyla ilgili sorunlar çıkarabilir. Bu, normalde glüten duyarlılığı olan insanlar için, özellikle pirinçten de kaçınan Aşkenazi Yahudileri için ikame olarak kullanılan diğer birçok tahılları ortadan kaldırır. Hamursuz Bayramı için birçok koşer ürün, tahıllardan tamamen kaçınır ve bu nedenle glütensizdir. Patates nişastası, tahılların yerini almak için kullanılan birincil nişastadır.
Yazım
Çölyak hastalığı İngiliz İngilizcesinde tercih edilen yazımdır, çölyak hastalığı ise tipik olarak Kuzey Amerika İngilizcesinde kullanılır.
REFERANSLAR
- ^ Jump up to:a b c d e f Fasano A (April 2005). "Clinical presentation of celiac disease in the pediatric population". Gastroenterology(Review). 128 (4 Suppl 1): S68–73. doi:10.1053/j.gastro.2005.02.015. PMID 15825129.
- ^ "Symptoms & Causes of Celiac Disease | NIDDK". National Institute of Diabetes and Digestive and Kidney Diseases. June 2016. Archived from the original on 24 April 2017. Retrieved 24 April 2017.
- ^ Jump up to:a b Lebwohl B, Ludvigsson JF, Green PH (October 2015). "Celiac disease and non-celiac gluten sensitivity". BMJ(Review). 351: h4347. doi:10.1136/bmj.h4347. PMC 4596973. PMID 26438584. Celiac disease occurs in about 1% of the population worldwide, although most people with the condition are undiagnosed. It can cause a wide variety of symptoms, both intestinal and extra-intestinal because it is a systemic autoimmune disease that is triggered by dietary gluten. Patients with coeliac disease are at increased risk of cancer, including a twofold to fourfold increased risk of non-Hodgkin’s lymphoma and a more than 30-fold increased risk of small intestinal adenocarcinoma, and they have a 1.4-fold increased risk of death.
- ^ Jump up to:a b c Lundin KE, Wijmenga C (September 2015). "Coeliac disease and autoimmune disease-genetic overlap and screening". Nature Reviews. Gastroenterology & Hepatology(Review). 12 (9): 507–15. doi:10.1038/nrgastro.2015.136. PMID 26303674. S2CID 24533103. The abnormal immunological response elicited by gluten-derived proteins can lead to the production of several different autoantibodies, which affect different systems.
- ^ Jump up to:a b c "Celiac disease". World Gastroenterology Organisation Global Guidelines. July 2016. Archived from the original on 17 March 2017. Retrieved 23 April 2017.
- ^ Jump up to:a b c d Ciccocioppo R, Kruzliak P, Cangemi GC, Pohanka M, Betti E, Lauret E, Rodrigo L (22 October 2015). "The Spectrum of Differences between Childhood and Adulthood Celiac Disease". Nutrients (Review). 7 (10): 8733–51. doi:10.3390/nu7105426. PMC 4632446. PMID 26506381. Several additional studies in extensive series of coeliac patients have clearly shown that TG2A sensitivity varies depending on the severity of duodenal damage, and reaches almost 100% in the presence of complete villous atrophy (more common in children under three years), 70% for subtotal atrophy, and up to 30% when only an increase in IELs is present. (IELs: intraepithelial lymphocytes)
- ^ Jump up to:a b Lionetti E, Francavilla R, Pavone P, Pavone L, Francavilla T, Pulvirenti A, Giugno R, Ruggieri M (August 2010). "The neurology of coeliac disease in childhood: what is the evidence? A systematic review and meta-analysis". Developmental Medicine and Child Neurology. 52 (8): 700–7. doi:10.1111/j.1469-8749.2010.03647.x. PMID 20345955.
- ^ Jump up to:a b c d e f Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Mäki M, Ribes-Koninckx C, Ventura A, Zimmer KP, ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (January 2012). "European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease" (PDF). J Pediatr Gastroenterol Nutr (Practice Guideline). 54 (1): 136–60. doi:10.1097/MPG.0b013e31821a23d0. PMID 22197856. S2CID 15029283. Archived from the original (PDF) on 3 April 2016. Retrieved 19 March 2016. Since 1990, the understanding of the pathological processes of CD has increased enormously, leading to a change in the clinical paradigm of CD from a chronic, gluten-dependent enteropathy of childhood to a systemic disease with chronic immune features affecting different organ systems. (...) atypical symptoms may be considerably more common than classic symptoms
- ^ Jump up to:a b Tovoli F, Masi C, Guidetti E, Negrini G, Paterini P, Bolondi L (March 2015). "Clinical and diagnostic aspects of gluten related disorders". World Journal of Clinical Cases (Review). 3 (3): 275–84. doi:10.12998/wjcc.v3.i3.275. PMC 4360499. PMID 25789300.
- ^ Jump up to:a b c d e f g "Celiac Disease". NIDDKD. June 2015. Archived from the original on 13 March 2016. Retrieved 17 March 2016.
- ^ Jump up to:a b c d Vivas S, Vaquero L, Rodríguez-Martín L, Caminero A (November 2015). "Age-related differences in celiac disease: Specific characteristics of adult presentation". World Journal of Gastrointestinal Pharmacology and Therapeutics (Review). 6 (4): 207–12. doi:10.4292/wjgpt.v6.i4.207. PMC 4635160. PMID 26558154. In addition, the presence of intraepithelial lymphocytosis and/or villous atrophy and crypt hyperplasia of small-bowel mucosa, and clinical remission after withdrawal of gluten from the diet, are also used for diagnosis antitransglutaminase antibody (tTGA) titers and the degree of histological lesions inversely correlate with age. Thus, as the age of diagnosis increases antibody titers decrease and histological damage is less marked. It is common to find adults without villous atrophy showing only an inflammatory pattern in duodenal mucosa biopsies: Lymphocytic enteritis (Marsh I) or added crypt hyperplasia (Marsh II)
- ^ Ferri, Fred F. (2010). Ferri's differential diagnosis : a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders (2nd ed.). Philadelphia, PA: Elsevier/Mosby. p. Chapter C. ISBN 978-0323076999.
- ^ Jump up to:a b c d See JA, Kaukinen K, Makharia GK, Gibson PR, Murray JA (October 2015). "Practical insights into gluten-free diets". Nature Reviews. Gastroenterology & Hepatology(Review). 12 (10): 580–91. doi:10.1038/nrgastro.2015.156. PMID 26392070. S2CID 20270743. A lack of symptoms and/or negative serological markers are not reliable indicators of mucosal response to the diet. Furthermore, up to 30% of patients continue to have gastrointestinal symptoms despite a strict GFD.122,124 If adherence is questioned, a structured interview by a qualified dietitian can help to identify both intentional and inadvertent sources of gluten.
- ^ Jump up to:a b c d Fasano A, Catassi C (December 2012). "Clinical practice. Celiac disease". The New England Journal of Medicine (Review). 367 (25): 2419–26. doi:10.1056/NEJMcp1113994. PMID 23252527.
- ^ Newnham, Evan D (2017). "Coeliac disease in the 21st century: Paradigm shifts in the modern age". Journal of Gastroenterology and Hepatology. 32: 82–85. doi:10.1111/jgh.13704. PMID 28244672. S2CID 46285202. Presentation of CD with malabsorptive symptoms or malnutrition is now the exception rather than the rule.
- ^ Jump up to:a b c Tonutti E, Bizzaro N (2014). "Diagnosis and classification of celiac disease and gluten sensitivity". Autoimmun Rev. 13 (4–5): 472–6. doi:10.1016/j.autrev.2014.01.043. PMID 24440147.
- ^ Jump up to:a b c Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (November 2013). "Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet". Nutrients (Review). 5 (11): 4553–65. doi:10.3390/nu5114553. PMC 3847748. PMID 24253052.
- ^ Jump up to:a b c d e f g h i j k l Di Sabatino A, Corazza GR (April 2009). "Coeliac disease". Lancet. 373 (9673): 1480–93. doi:10.1016/S0140-6736(09)60254-3. PMID 19394538. S2CID 8415780.
- ^ Pinto-Sánchez MI, Causada-Calo N, Bercik P, Ford AC, Murray JA, Armstrong D, Semrad C, Kupfer SS, Alaedini A, Moayyedi P, Leffler DA, Verdú EF, Green P (August 2017). "Safety of Adding Oats to a Gluten-Free Diet for Patients With Celiac Disease: Systematic Review and Meta-analysis of Clinical and Observational Studies" (PDF). Gastroenterology. 153 (2): 395–409.e3. doi:10.1053/j.gastro.2017.04.009. PMID 28431885.
- ^ Jump up to:a b c d e Comino I, Moreno M, Sousa C (November 2015). "Role of oats in celiac disease". World Journal of Gastroenterology. 21 (41): 11825–31. doi:10.3748/wjg.v21.i41.11825. PMC 4631980. PMID 26557006. It is necessary to consider that oats include many varieties, containing various amino acid sequences and showing different immunoreactivities associated with toxic prolamins. As a result, several studies have shown that the immunogenicity of oats varies depending on the cultivar consumed. Thus, it is essential to thoroughly study the variety of oats used in a food ingredient before including it in a gluten-free diet.
- ^ Jump up to:a b c d e f g h i National Institute for Health and Clinical Excellence. Clinical guideline 86: Recognition and assessment of coeliac disease. London, 2015.
- ^ Jump up to:a b Matthias T, Pfeiffer S, Selmi C, Eric Gershwin M (April 2010). "Diagnostic challenges in celiac disease and the role of the tissue transglutaminase-neo-epitope". Clin Rev Allergy Immunol (Review). 38 (2–3): 298–301. doi:10.1007/s12016-009-8160-z. PMID 19629760. S2CID 33661098.
- ^ Jump up to:a b c Lewis NR, Scott BB (July 2006). "Systematic review: the use of serology to exclude or diagnose coeliac disease (a comparison of the endomysial and tissue transglutaminase antibody tests)". Alimentary Pharmacology & Therapeutics. 24(1): 47–54. doi:10.1111/j.1365-2036.2006.02967.x. PMID 16803602. S2CID 16823218.
- ^ Jump up to:a b c d e f Rostom A, Murray JA, Kagnoff MF (December 2006). "American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease". Gastroenterology (Review). 131 (6): 1981–2002. doi:10.1053/j.gastro.2006.10.004. PMID 17087937.
- ^ Jump up to:a b Molina-Infante J, Santolaria S, Sanders DS, Fernández-Bañares F (May 2015). "Systematic review: noncoeliac gluten sensitivity". Alimentary Pharmacology & Therapeutics(Review). 41 (9): 807–20. doi:10.1111/apt.13155. PMID 25753138. S2CID 207050854. Furthermore, seronegativity is more common in coeliac disease patients without villous atrophy (Marsh 1-2 lesions), but these ‘minor’ forms of coeliac disease may have similar clinical manifestations to those with villous atrophy and may show similar clinical–histological remission with reversal of haematological or biochemical disturbances on a gluten-free diet (GFD).
- ^ Jump up to:a b c d Cichewicz AB, Mearns ES, Taylor A, Boulanger T, Gerber M, Leffler DA, et al. (1 March 2019). "Diagnosis and Treatment Patterns in Celiac Disease". Dig Dis Sci (Review). 64 (8): 2095–2106. doi:10.1007/s10620-019-05528-3. PMID 30820708. S2CID 71143826.
- ^ Jump up to:a b Ludvigsson JF, Card T, Ciclitira PJ, Swift GL, Nasr I, Sanders DS, Ciacci C (April 2015). "Support for patients with celiac disease: A literature review". United European Gastroenterology Journal (Review). 3 (2): 146–59. doi:10.1177/2050640614562599. PMC 4406900. PMID 25922674.
- ^ Jump up to:a b c d e f g h i j k l m n o p q van Heel DA, West J (July 2006). "Recent advances in coeliac disease". Gut (Review). 55 (7): 1037–46. doi:10.1136/gut.2005.075119. PMC 1856316. PMID 16766754.
- ^ Jump up to:a b Bibbins-Domingo K, Grossman DC, Curry SJ, Barry MJ, Davidson KW, Doubeni CA, Ebell M, Epling JW, Herzstein J, Kemper AR, Krist AH, Kurth AE, Landefeld CS, Mangione CM, Phipps MG, Silverstein M, Simon MA, Tseng CW (March 2017). "Screening for Celiac Disease: US Preventive Services Task Force Recommendation Statement". JAMA. 317 (12): 1252–1257. doi:10.1001/jama.2017.1462. PMID 28350936. S2CID 205086614.
- ^ Burkhardt, J. G.; Chapa-Rodriguez, A.; Bahna, S. L. (July 2018). "Gluten sensitivities and the allergist: Threshing the grain from the husks". Allergy. 73 (7): 1359–1368. doi:10.1111/all.13354. PMID 29131356.
- ^ Jump up to:a b Lionetti E, Gatti S, Pulvirenti A, Catassi C (June 2015). "Celiac disease from a global perspective". Best Practice & Research. Clinical Gastroenterology (Review). 29 (3): 365–79. doi:10.1016/j.bpg.2015.05.004. PMID 26060103.
- ^ Jump up to:a b Hischenhuber C, Crevel R, Jarry B, Mäki M, Moneret-Vautrin DA, Romano A, Troncone R, Ward R (March 2006). "Review article: safe amounts of gluten for patients with wheat allergy or coeliac disease". Alimentary Pharmacology & Therapeutics. 23 (5): 559–75. doi:10.1111/j.1365-2036.2006.02768.x. PMID 16480395. S2CID 9970042.
- ^ Schuppan D, Zimmer KP (December 2013). "The diagnosis and treatment of celiac disease". Deutsches Ärzteblatt International. 110 (49): 835–46. doi:10.3238/arztebl.2013.0835. PMC 3884535. PMID 24355936.
- ^ Vriezinga SL, Schweizer JJ, Koning F, Mearin ML (September 2015). "Coeliac disease and gluten-related disorders in childhood". Nature Reviews. Gastroenterology & Hepatology (Review). 12 (9): 527–36. doi:10.1038/nrgastro.2015.98. PMID 26100369. S2CID 2023530.
- ^ Ferguson R, Basu MK, Asquith P, Cooke WT (1976). "Jejunal mucosal abnormalities in patients with recurrent aphthous ulceration". Br Med J. 1 (6000): 11–13. doi:10.1136/bmj.1.6000.11. PMC 1638254. PMID 1247715.
- ^ Jump up to:a b Irvine, AJ; Chey, WD; Ford, AC (January 2017). "Screening for Celiac Disease in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-analysis" (PDF). The American Journal of Gastroenterology. 112 (1): 65–76. doi:10.1038/ajg.2016.466. PMID 27753436. S2CID 269053.
- ^ Jump up to:a b National Institute for Health and Clinical Excellence. Clinical guideline 61: Irritable bowel syndrome. London, 2008.
- ^ Fasano Alessio, Caio Giacomo; Catassi Carlo, Volta Umberto (July 2019). "Celiac disease: a comprehensive current review". BMC Medicine. Springer Nature. 17 (1): 142. doi:10.1186/s12916-019-1380-z. PMC 6647104. PMID 31331324.
- ^ Jump up to:a b c d e Gujral N, Freeman HJ, Thomson AB (November 2012). "Celiac disease: prevalence, diagnosis, pathogenesis and treatment" (PDF). World Journal of Gastroenterology. 18 (42): 6036–59. doi:10.3748/wjg.v18.i42.6036. PMC 3496881. PMID 23155333. Archived from the original (PDF) on 20 March 2014.
- ^ Jump up to:a b c d e f g h "American Gastroenterological Association medical position statement: Celiac Sprue". Gastroenterology. 120 (6): 1522–5. 2001. doi:10.1053/gast.2001.24055. PMID 11313323. S2CID 28235994.
- ^ Jump up to:a b c Presutti RJ, Cangemi JR, Cassidy HD, Hill DA (2007). "Celiac disease". Am Fam Physician. 76 (12): 1795–802. PMID 18217518.
- ^ Jump up to:a b Pietzak MM (2014). "Dietary supplements in celiac disease". In Rampertab SD, Mullin GE (eds.). Celiac disease. pp. 137–59. ISBN 978-1-4614-8559-9.
- ^ Cunningham-Rundles C (September 2001). "Physiology of IgA and IgA deficiency". J. Clin. Immunol. 21 (5): 303–9. doi:10.1023/A:1012241117984. PMID 11720003. S2CID 13285781.
- ^ Jump up to:a b Marks J, Shuster S, Watson AJ (1966). "Small-bowel changes in dermatitis herpetiformis". Lancet. 2 (7476): 1280–2. doi:10.1016/S0140-6736(66)91692-8. PMID 4163419.
- ^ Nicolas ME, Krause PK, Gibson LE, Murray JA (August 2003). "Dermatitis herpetiformis". Int. J. Dermatol. 42 (8): 588–600. doi:10.1046/j.1365-4362.2003.01804.x. PMID 12890100. S2CID 42280769.
- ^ Jump up to:a b Tersigni C, Castellani R, de Waure C, Fattorossi A, De Spirito M, Gasbarrini A, Scambia G, Di Simone N (2014). "Celiac disease and reproductive disorders: meta-analysis of epidemiologic associations and potential pathogenic mechanisms". Human Reproduction Update. 20 (4): 582–93. doi:10.1093/humupd/dmu007. PMID 24619876.
- ^ Ferguson A, Hutton MM, Maxwell JD, Murray D (1970). "Adult coeliac disease in hyposplenic patients". Lancet. 1(7639): 163–4. doi:10.1016/S0140-6736(70)90405-8. PMID 4189238.
- ^ Kupfer SS, Jabri B (2012). "Pathophysiology of celiac disease". Gastrointest Endosc Clin N Am (Review). 22 (4): 639–60. doi:10.1016/j.giec.2012.07.003. PMC 3872820. PMID 23083984. Gluten comprises two different protein types, gliadins and glutenins, capable of triggering disease.
- ^ Jump up to:a b c d Biesiekierski, Jessica R (2017). "What is gluten?". Journal of Gastroenterology and Hepatology. 32: 78–81. doi:10.1111/jgh.13703. PMID 28244676. S2CID 6493455. Similar proteins to the gliadin found in wheat exist as secalin in rye, hordein in barley, and avenins in oats and are collectively referred to as “gluten.” Derivatives of these grains such as triticale and malt and other ancient wheat varieties such as spelt and kamut also contain gluten. The gluten found in all of these grains has been identified as the component capable of triggering the immune-mediated disorder, coeliac disease.
- ^ Jump up to:a b c d Kupper C (2005). "Dietary guidelines and implementation for celiac disease". Gastroenterology. 128 (4 Suppl 1): S121–7. doi:10.1053/j.gastro.2005.02.024. PMID 15825119.
- ^ Jump up to:a b Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (18 November 2013). "Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet". Nutrients. 5 (11): 4553–65. doi:10.3390/nu5114553. PMC 3847748. PMID 24253052.
- ^ Jump up to:a b de Souza MC, Deschênes ME, Laurencelle S, Godet P, Roy CC, Djilali-Saiah I (2016). "Pure Oats as Part of the Canadian Gluten-Free Diet in Celiac Disease: The Need to Revisit the Issue". Can J Gastroenterol Hepatol (Review). 2016: 1–8. doi:10.1155/2016/1576360. PMC 4904650. PMID 27446824.
- ^ Jump up to:a b Haboubi NY, Taylor S, Jones S (October 2006). "Coeliac disease and oats: a systematic review". Postgrad Med J(Review). 82 (972): 672–8. doi:10.1136/pgmj.2006.045443. PMC 2653911. PMID 17068278.
- ^ Gallagher, Eimear (2009). Gluten-free Food Science and Technology. Published by John Wiley and Sons. p. 320. ISBN 978-1-4051-5915-9. Archived from the original on 17 June 2009.
- ^ "The Gluten Connection". Health Canada. May 2009. Archived from the original on 5 July 2017. Retrieved 1 October 2013.
- ^ Pinto-Sánchez MI, Verdu EF, Liu E, Bercik P, Green PH, Murray JA, Guandalini S, Moayyedi P (January 2016). "Gluten Introduction to Infant Feeding and Risk of Celiac Disease: Systematic Review and Meta-Analysis". The Journal of Pediatrics. 168: 132–43.e3. doi:10.1016/j.jpeds.2015.09.032. PMID 26500108.
- ^ Ierodiakonou D, Garcia-Larsen V, Logan A, Groome A, Cunha S, Chivinge J, Robinson Z, Geoghegan N, Jarrold K, Reeves T, Tagiyeva-Milne N, Nurmatov U, Trivella M, Leonardi-Bee J, Boyle RJ (September 2016). "Timing of Allergenic Food Introduction to the Infant Diet and Risk of Allergic or Autoimmune Disease: A Systematic Review and Meta-analysis". JAMA. 316 (11): 1181–1192. doi:10.1001/jama.2016.12623. hdl:10044/1/40479. PMID 27654604.
- ^ Akobeng AK, Ramanan AV, Buchan I, Heller RF (January 2006). "Effect of breast feeding on risk of coeliac disease: a systematic review and meta-analysis of observational studies". Archives of Disease in Childhood. 91 (1): 39–43. doi:10.1136/adc.2005.082016. PMC 2083075. PMID 16287899.
- ^ Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, Barbato M, Barbera C, Barera G, Bellantoni A, Castellano E, Guariso G, Limongelli MG, Pellegrino S, Polloni C, Ughi C, Zuin G, Fasano A, Catassi C (October 2014). "Introduction of gluten, HLA status, and the risk of celiac disease in children". The New England Journal of Medicine(comparative study). 371 (14): 1295–303. doi:10.1056/NEJMoa1400697. hdl:2318/155238. PMID 25271602.
- ^ Longmore, Murray (2014). Oxford handbook of Clinical Medicine. Oxford University Press. p. 280. ISBN 9780199609628.
- ^ Jump up to:a b c Hadithi M, von Blomberg BM, Crusius JB, Bloemena E, Kostense PJ, Meijer JW, Mulder CJ, Stehouwer CD, Peña AS (2007). "Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease". Ann. Intern. Med. 147 (5): 294–302. doi:10.7326/0003-4819-147-5-200709040-00003. PMID 17785484. S2CID 24275278.
- ^ Kim C, Quarsten H, Bergseng E, Khosla C, Sollid L (2004). "Structural basis for HLA-DQ2-mediated presentation of gluten epitopes in celiac disease". Proc Natl Acad Sci USA. 101(12): 4175–9. Bibcode:2004PNAS..101.4175K. doi:10.1073/pnas.0306885101. PMC 384714. PMID 15020763.
- ^ Jores RD, Frau F, Cucca F, Grazia Clemente M, Orrù S, Rais M, De Virgiliis S, Congia M (2007). "HLA-DQB1*0201 homozygosis predisposes to severe intestinal damage in celiac disease". Scand. J. Gastroenterol. 42 (1): 48–53. doi:10.1080/00365520600789859. PMID 17190762. S2CID 7675714.
- ^ Karell K, Louka AS, Moodie SJ, Ascher H, Clot F, Greco L, Ciclitira PJ, Sollid LM, Partanen J (2003). "HLA types in celiac disease patients not carrying the DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European Genetics Cluster on Celiac Disease". Hum. Immunol. 64 (4): 469–77. doi:10.1016/S0198-8859(03)00027-2. PMID 12651074.
- ^ Michalski JP, McCombs CC, Arai T, Elston RC, Cao T, McCarthy CF, Stevens FM (1996). "HLA-DR, DQ genotypes of celiac disease patients and healthy subjects from the West of Ireland". Tissue Antigens. 47 (2): 127–33. doi:10.1111/j.1399-0039.1996.tb02525.x. PMID 8851726.
- ^ Kaur G, Sarkar N, Bhatnagar S, Kumar S, Rapthap CC, Bhan MK, Mehra NK (2002). "Pediatric celiac disease in India is associated with multiple DR3-DQ2 haplotypes". Hum. Immunol. 63 (8): 677–82. doi:10.1016/S0198-8859(02)00413-5. PMID 12121676.
- ^ Layrisse Z, Guedez Y, Domínguez E, Paz N, Montagnani S, Matos M, Herrera F, Ogando V, Balbas O, Rodríguez-Larralde A (2001). "Extended HLA haplotypes in a Carib Amerindian population: the Yucpa of the Perija Range". Hum Immunol. 62(9): 992–1000. doi:10.1016/S0198-8859(01)00297-X. PMID 11543901.
- ^ Jump up to:a b Dubois PC, Trynka G, Franke L, Hunt KA, Romanos J, Curtotti A, Zhernakova A, Heap GA, Adány R, Aromaa A, Bardella MT, van den Berg LH, Bockett NA, de la Concha EG, Dema B, Fehrmann RS, Fernández-Arquero M, Fiatal S, Grandone E, Green PM, Groen HJ, Gwilliam R, Houwen RH, Hunt SE, Kaukinen K, Kelleher D, Korponay-Szabo I, Kurppa K, MacMathuna P, Mäki M, Mazzilli MC, McCann OT, Mearin ML, Mein CA, Mirza MM, Mistry V, Mora B, Morley KI, Mulder CJ, Murray JA, Núñez C, Oosterom E, Ophoff RA, Polanco I, Peltonen L, Platteel M, Rybak A, Salomaa V, Schweizer JJ, Sperandeo MP, Tack GJ, Turner G, Veldink JH, Verbeek WH, Weersma RK, Wolters VM, Urcelay E, Cukrowska B, Greco L, Neuhausen SL, McManus R, Barisani D, Deloukas P, Barrett JC, Saavalainen P, Wijmenga C, van Heel DA (2010). "Multiple common variants for celiac disease influencing immune gene expression". Nature Genetics. 42 (4): 295–302. doi:10.1038/ng.543. PMC 2847618. PMID 20190752.
- ^ Walcher DN, Kretchmer N (1981). Food, nutrition, and evolution: food as an environmental factor in the genesis of human variability. Papers presented at the International Congress of the International Organization for the Study of Human Development, Masson Pub. USA. pp. 179–199. ISBN 978-0-89352-158-5.
- ^ Catassi C (2005). "Where Is Celiac Disease Coming From and Why?". Journal of Pediatric Gastroenterology & Nutrition. 40 (3): 279–282. doi:10.1097/01.MPG.0000151650.03929.D5. PMID 15735480. S2CID 12843113.
- ^ Zhernakova A, Elbers CC, Ferwerda B, Romanos J, Trynka G, Dubois PC, de Kovel CG, Franke L, Oosting M, Barisani D, Bardella MT, Joosten LA, Saavalainen P, van Heel DA, Catassi C, Netea MG, Wijmenga C (2010). "Evolutionary and functional analysis of celiac risk loci reveals SH2B3 as a protective factor against bacterial infection". American Journal of Human Genetics. 86 (6): 970–7. doi:10.1016/j.ajhg.2010.05.004. PMC 3032060. PMID 20560212.
- ^ Green PH, Cellier C (2007). "Celiac disease". N. Engl. J. Med. 357 (17): 1731–43. doi:10.1056/NEJMra071600. PMID 17960014.
- ^ Lammers KM, Lu R, Brownley J, Lu B, Gerard C, Thomas K, Rallabhandi P, Shea-Donohue T, Tamiz A, Alkan S, Netzel-Arnett S, Antalis T, Vogel SN, Fasano A (2008). "Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3". Gastroenterology. 135 (1): 194–204.e3. doi:10.1053/j.gastro.2008.03.023. PMC 2653457. PMID 18485912.
- ^ Jump up to:a b Qiao SW, Bergseng E, Molberg Ø, et al. (August 2004). "Antigen presentation to celiac lesion-derived T cells of a 33-mer gliadin peptide naturally formed by gastrointestinal digestion". J. Immunol. 173 (3): 1757–62. doi:10.4049/jimmunol.173.3.1757. PMID 15265905. S2CID 24910686.
- ^ Shan L, Qiao SW, Arentz-Hansen H, Molberg Ø, Gray GM, Sollid LM, Khosla C (2005). "Identification and analysis of multivalent proteolytically resistant peptides from gluten: implications for celiac sprue". J. Proteome Res. 4 (5): 1732–41. doi:10.1021/pr050173t. PMC 1343496. PMID 16212427.
- ^ Jump up to:a b Skovbjerg H, Norén O, Anthonsen D, Moller J, Sjöström H (2002). "Gliadin is a good substrate of several transglutaminases: possible implication in the pathogenesis of coeliac disease". Scand J Gastroenterol. 37 (7): 812–7. doi:10.1080/713786534. PMID 12190095.
- ^ Fleckenstein B, Molberg Ø, Qiao SW, Schmid DG, von der Mülbe F, Elgstøen K, Jung G, Sollid LM (2002). "Gliadin T cell epitope selection by tissue transglutaminase in celiac disease. Role of enzyme specificity and pH influence on the transamidation versus deamidation process". J Biol Chem. 277 (37): 34109–34116. doi:10.1074/jbc.M204521200. PMID 12093810. S2CID 7102008.
- ^ Koning F, Schuppan D, Cerf-Bensussan N, Sollid LM (June 2005). "Pathomechanisms in celiac disease". Best Practice & Research. Clinical Gastroenterology. 19 (3): 373–387. doi:10.1016/j.bpg.2005.02.003. ISSN 1521-6918. PMID 15925843.
- ^ Mowat AM (2003). "Coeliac disease – a meeting point for genetics, immunology, and protein chemistry". Lancet. 361(9365): 1290–1292. doi:10.1016/S0140-6736(03)12989-3. PMID 12699968. S2CID 10259661.
- ^ Dewar D, Pereira SP, Ciclitira PJ (2004). "The pathogenesis of coeliac disease". Int J Biochem Cell Biol. 36 (1): 17–24. doi:10.1016/S1357-2725(03)00239-5. PMID 14592529.
- ^ Kaukinen K, Peräaho M, Collin P, Partanen J, Woolley N, Kaartinen T, Nuutinen T, Halttunen T, Mäki M, Korponay-Szabo I (2005). "Small-bowel mucosal tranglutaminase 2-specific IgA deposits in coeliac disease without villous atrophy: A Prospective and radmonized clinical study". Scand J Gastroenterol. 40 (5): 564–572. doi:10.1080/00365520510023422. PMID 16036509. S2CID 27068601.
- ^ Salmi TT, Collin P, Korponay-Szabó IR, Laurila K, Partanen J, Huhtala H, Király R, Lorand L, Reunala T, Mäki M, Kaukinen K (2006). "Endomysial antibody-negative coeliac disease: clinical characteristics and intestinal autoantibody deposits". Gut. 55 (12): 1746–53. doi:10.1136/gut.2005.071514. PMC 1856451. PMID 16571636.
- ^ Londei M, Ciacci C, Ricciardelli I, Vacca L, Quaratino S, Maiuri L (2005). "Gliadin as a stimulator of innate responses in celiac disease". Mol Immunol. 42 (8): 913–918. doi:10.1016/j.molimm.2004.12.005. PMID 15829281.
- ^ Zanoni G, Navone R, Lunardi C, Tridente G, Bason C, Sivori S, Beri R, Dolcino M, Valletta E, Corrocher R, Puccetti A (2006). "In celiac disease, a subset of autoantibodies against transglutaminase binds toll-like receptor 4 and induces activation of monocytes". PLOS Med. 3 (9): e358. doi:10.1371/journal.pmed.0030358. PMC 1569884. PMID 16984219.
- ^ Salim AF, Phillips AD, Farthing MJ (1990). "Pathogenesis of gut virus infection". Baillière's Clinical Gastroenterology. 4(3): 593–607. doi:10.1016/0950-3528(90)90051-H. PMC 7172617. PMID 1962725.
- ^ "Celiac disease: A review". BCMJ. 43 (7): 390–395. September 2001. Archived from the original on 22 February 2014. Retrieved 15 February 2014.
- ^ Jump up to:a b c d van der Windt DA, Jellema P, Mulder CJ, Kneepkens CM, van der Horst HE (2010). "Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review". JAMA. 303 (17): 1738–46. doi:10.1001/jama.2010.549. PMID 20442390. Most studies used similar histological criteria for diagnosing celiac disease (Marsh grade ≥III), but the level of damage may vary across populations. Only 4 studies presented the proportion of patients in whom only partial villous atrophy was found (Marsh grade of IIIA), which ranged from 4% to 100%. The presence of positive serum antibodies has been shown to correlate with the degree of villous atrophy, and patients with celiac disease who have less severe histological damage may have seronegative findings. This could be important, especially in primary care, in which levels of mucosal damage may be lower, and consequently, more patients with celiac disease may be missed.
- ^ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, Not T (2000). "Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease". Am. J. Gastroenterol. 95(5): 1253–57. PMID 10811336.
- ^ Korponay-Szabó IR, Dahlbom I, Laurila K, Koskinen S, Woolley N, Partanen J, Kovács JB, Mäki M, Hansson T (2003). "Elevation of IgG antibodies against tissue transglutaminase as a diagnostic tool for coeliac disease in selective IgA deficiency". Gut. 52 (11): 1567–71. doi:10.1136/gut.52.11.1567. PMC 1773847. PMID 14570724.
- ^ Jump up to:a b Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, Hoffenberg EJ, Horvath K, Murray JA, Pivor M, Seidman EG (2005). "Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition". J. Pediatr. Gastroenterol. Nutr. 40(1): 1–19. doi:10.1097/00005176-200501000-00001. PMID 15625418. S2CID 14805217.
- ^ Jump up to:a b Hill ID (April 2005). "What are the sensitivity and specificity of serologic tests for celiac disease? Do sensitivity and specificity vary in different populations?" (PDF). Gastroenterology. 128 (4 Suppl 1): S25–32. doi:10.1053/j.gastro.2005.02.012. PMID 15825123. Archived (PDF) from the original on 14 April 2007.
- ^ Nandiwada SL, Tebo AE (April 2013). "Testing for antireticulin antibodies in patients with celiac disease is obsolete: a review of recommendations for serologic screening and the literature". Clin. Vaccine Immunol. 20 (4): 447–51. doi:10.1128/CVI.00568-12. PMC 3623418. PMID 23365209.
- ^ Wong RC, Steele RH, Reeves GE, Wilson RJ, Pink A, Adelstein S (2003). "Antibody and genetic testing in coeliac disease". Pathology. 35 (4): 285–304. doi:10.1080/00313020307527. PMID 12959764.
- ^ Fagoonee S, De Luca L, De Angelis C, Castelli A, Rizzetto M, Pellicano R (March 2009). "Anti-Saccharomyces cerevisiae as unusual antibodies in autoimmune hepatitis". Minerva Gastroenterologica e Dietologica. 55 (1): 37–40. PMID 19212306.
- ^ Niveloni S, Fiorini A, Dezi R, Pedreira S, Smecuol E, Vazquez H, Cabanne A, Boerr LA, Valero J, Kogan Z, Mauriño E, Bai JC (1998). "Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease: assessment of interobserver agreement". Gastrointestinal Endoscopy. 47 (3): 223–29. doi:10.1016/S0016-5107(98)70317-7. PMID 9580349.
- ^ Mee AS, Burke M, Vallon AG, Newman J, Cotton PB (1985). "Small bowel biopsy for malabsorption: comparison of the diagnostic adequacy of endoscopic forceps and capsule biopsy specimens". The BMJ. 291 (6498): 769–72. doi:10.1136/bmj.291.6498.769. PMC 1417146. PMID 3929934.
- ^ Redondo-Cerezo E, Sánchez-Capilla AD, De La Torre-Rubio P, De Teresa J (November 2014). "Wireless capsule endoscopy: Perspectives beyond gastrointestinal bleeding". World J. Gastroenterol. 20 (42): 15664–73. doi:10.3748/wjg.v20.i42.15664. PMC 4229531. PMID 25400450.
- ^ Marsh MN (1992). "Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity ('celiac sprue')". Gastroenterology. 102 (1): 330–54. doi:10.1016/0016-5085(92)91819-p. PMID 1727768.
- ^ Corazza GR, Villanacci V (1 June 2005). "Coeliac disease". J. Clin. Pathol. 58 (6): 573–74. doi:10.1136/jcp.2004.023978. PMC 1770677. PMID 15917404.
- ^ Oberhuber G, Granditsch G, Vogelsang H (October 1999). "The histopathology of coeliac disease: time for a standardized report scheme for pathologists". Eur. J. Gastroenterol. Hepatol. 11 (10): 1185–94. doi:10.1097/00042737-199910000-00019. PMID 10524652.
- ^ Corazza GR, Villanacci V, Zambelli C, Milione M, Luinetti O, Vindigni C, Chioda C, Albarello L, Bartolini D, Donato F (2007). "Comparison of the interobserver reproducibility with different histologic criteria used in celiac disease". Clin. Gastroenterol. Hepatol. 5 (7): 838–43. doi:10.1016/j.cgh.2007.03.019. PMID 17544877.
- ^ Ontiveros N, Hardy MY, Cabrera-Chavez F (2015). "Assessing of Celiac Disease and Nonceliac Gluten Sensitivity". Gastroenterology Research and Practice(Review). 2015: 1–13. doi:10.1155/2015/723954. PMC 4429206. PMID 26064097.
- ^ Genuis SJ, Lobo RA (2014). "Gluten sensitivity presenting as a neuropsychiatric disorder". Gastroenterol Res Pract(Review). 2014: 293206. doi:10.1155/2014/293206. PMC 3944951. PMID 24693281.
- ^ Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, Hadjivassiliou M, Kaukinen K, Kelly CP, Leonard JN, Lundin KE, Murray JA, Sanders DS, Walker MM, Zingone F, Ciacci C (January 2013). "The Oslo definitions for coeliac disease and related terms". Gut. 62 (1): 43–52. doi:10.1136/gutjnl-2011-301346. PMC 3440559. PMID 22345659.
- ^ Elli L, Roncoroni L, Bardella MT (July 2015). "Non-celiac gluten sensitivity: Time for sifting the grain". World J Gastroenterol (Review). 21 (27): 8221–6. doi:10.3748/wjg.v21.i27.8221. PMC 4507091. PMID 26217073.
- ^ Fasano A, Sapone A, Zevallos V, Schuppan D (May 2015). "Nonceliac gluten sensitivity". Gastroenterology (Review). 148(6): 1195–204. doi:10.1053/j.gastro.2014.12.049. PMID 25583468.
- ^ Jump up to:a b Castillo NE, Theethira TG, Leffler DA (February 2015). "The present and the future in the diagnosis and management of celiac disease". Gastroenterology Report (Review). 3 (1): 3–11. doi:10.1093/gastro/gou065. PMC 4324867. PMID 25326000.
- ^ Jump up to:a b c d e Levy J, Bernstein L, Silber N (December 2014). "Celiac disease: an immune dysregulation syndrome". Current Problems in Pediatric and Adolescent Health Care (Review). 44 (11): 324–7. doi:10.1016/j.cppeds.2014.10.002. PMID 25499458. Initially, reduced levels of lactase and sucrase activities might necessitate further dietary restrictions until the villi have healed and those sugars are better tolerated.
- ^ Jump up to:a b c d Montalto M, Gallo A, Ojetti V, Gasbarrini A (2013). "Fructose, trehalose and sorbitol malabsorption" (PDF). European Review for Medical and Pharmacological Sciences(Review). 17 Suppl 2 (Suppl 2): 26–9. PMID 24443064. Archived (PDF) from the original on 12 April 2016.
- ^ Jump up to:a b Leffler DA, Green PH, Fasano A (October 2015). "Extraintestinal manifestations of coeliac disease". Nature Reviews. Gastroenterology & Hepatology (Review). 12 (10): 561–71. doi:10.1038/nrgastro.2015.131. PMID 26260366. S2CID 15561525.
- ^ Jump up to:a b c d e f g h i Woodward J (3 August 2016). "Improving outcomes of refractory celiac disease - current and emerging treatment strategies". Clinical and Experimental Gastroenterology (Review). 9: 225–36. doi:10.2147/ceg.s87200. PMC 4976763. PMID 27536154.
- ^ Jump up to:a b c Berni Canani R, Pezzella V, Amoroso A, Cozzolino T, Di Scala C, Passariello A (March 2016). "Diagnosing and Treating Intolerance to Carbohydrates in Children". Nutrients. 8 (3): 157. doi:10.3390/nu8030157. PMC 4808885. PMID 26978392.
- ^ Jump up to:a b c García-Manzanares A, Lucendo AJ (April 2011). "Nutritional and dietary aspects of celiac disease". Nutrition in Clinical Practice (Review). 26 (2): 163–73. doi:10.1177/0884533611399773. PMID 21447770.
- ^ Jump up to:a b c d Green PH, Jabri B (August 2003). "Coeliac disease". Lancet (Review). 362 (9381): 383–91. doi:10.1016/S0140-6736(03)14027-5. PMID 12907013. S2CID 39188931.
- ^ Volta U, Caio G, Tovoli F, De Giorgio R (September 2013). "Non-celiac gluten sensitivity: questions still to be answered despite increasing awareness". Cellular & Molecular Immunology (Review). 10 (5): 383–92. doi:10.1038/cmi.2013.28. PMC 4003198. PMID 23934026.
- ^ National Institute for Health and Clinical Excellence. Clinical guideline 53: Chronic fatigue syndrome/myalgic encephalomyelitis. London, 2007.
- ^ Murch S, Jenkins H, Auth M, Bremner R, Butt A, France S, Furman M, Gillett P, Kiparissi F, Lawson M, McLain B, Morris MA, Sleet S, Thorpe M (October 2013). "Joint BSPGHAN and Coeliac UK guidelines for the diagnosis and management of coeliac disease in children". Archives of Disease in Childhood. 98 (10): 806–11. doi:10.1136/archdischild-2013-303996. PMID 23986560. S2CID 30417933.
- ^ Han Y, Chen W, Li P, Ye J (2015). "Association Between Coeliac Disease and Risk of Any Malignancy and Gastrointestinal Malignancy: A Meta-Analysis". Medicine (Baltimore) (Meta-Analysis). 94 (38): e1612. doi:10.1097/MD.0000000000001612. PMC 4635766. PMID 26402826.
- ^ Jump up to:a b Ciaccio EJ, Lewis SK, Biviano AB, Iyer V, Garan H, Green PH (2017). "Cardiovascular involvement in celiac disease". World J Cardiol (Review). 9 (8): 652–666. doi:10.4330/wjc.v9.i8.652. PMC 5583538. PMID 28932354.
- ^ Treem WR (2004). "Emerging concepts in celiac disease". Curr Opin Pediatr. 16 (5): 552–9. doi:10.1097/01.mop.0000142347.74135.73. PMID 15367850. S2CID 20221260.
- ^ Lee AR, Ng DL, Zivin J, Green PH (2007). "Economic burden of a gluten-free diet" (PDF). J Hum Nutr Diet. 20 (5): 423–30. CiteSeerX 10.1.1.662.8399. doi:10.1111/j.1365-277X.2007.00763.x. PMID 17845376. Archived from the original (PDF) on 24 June 2015. Retrieved 9 February2018.
- ^ Troncone R, Ivarsson A, Szajewska H, Mearin ML (2008). "Review article: future research on coeliac disease – a position report from the European multistakeholder platform on coeliac disease (CDEUSSA)". Aliment. Pharmacol. Ther. 27 (11): 1030–43. doi:10.1111/j.1365-2036.2008.03668.x. PMID 18315588. S2CID 30241867.
- ^ Jump up to:a b Akobeng AK, Thomas AG (June 2008). "Systematic review: tolerable amount of gluten for people with coeliac disease". Aliment. Pharmacol. Ther. 27 (11): 1044–52. doi:10.1111/j.1365-2036.2008.03669.x. PMID 18315587. S2CID 20539463.
- ^ "Gluten-free food". Directorate-General for Health and Consumers. Archived from the original on 23 July 2015. Retrieved 25 July 2015.
- ^ "What is Gluten-Free? FDA Has an Answer". Food and Drug Administration. 2 August 2013. Archived from the original on 4 August 2013. Retrieved 2 August 2013. As one of the criteria for using the claim 'gluten-free,' FDA is setting a gluten limit of less than 20 ppm (parts per million) in foods that carry this label. This is the lowest level that can be consistently detected in foods using valid scientific analytical tools. Also, most people with celiac disease can tolerate foods with very small amounts of gluten. This level is consistent with those set by other countries and international bodies that set food safety standards.
- ^ Section 206 of the Food Allergen Labeling and Consumer Protection Act of 2004, Title II of Pub.L. 108–282 (text)(pdf), 118 Stat. 891 , enacted August 2, 2004
- ^ 78 FR 47154 (5 August 2013). Codified at 21 C.F.R.101.91.
- ^ "Current Official Standards". FAO/WHO. Archived from the original on 4 June 2011.
- ^ Anderson, Jane. "Certified Gluten-Free Products: What Does Gluten-Free Certification Mean For Consumers?". About.com. Archived from the original on 12 April 2014. Retrieved 4 March 2014.
- ^ Burger JP, de Brouwer B, IntHout J, Wahab PJ, Tummers M, Drenth JP (April 2017). "Systematic review with meta-analysis: Dietary adherence influences normalization of health-related quality of life in coeliac disease". Clinical Nutrition. 36 (2): 399–406. doi:10.1016/j.clnu.2016.04.021. PMID 27179800.
- ^ Mulder CJ, van Wanrooij RL, Bakker SF, Wierdsma N, Bouma G (2013). "Gluten-free diet in gluten-related disorders". Dig. Dis. (Review). 31 (1): 57–62. doi:10.1159/000347180. PMID 23797124. S2CID 14124370.
- ^ Jump up to:a b c Lebwohl B, Ludvigsson JF, Green PH (October 2015). "Celiac disease and non-celiac gluten sensitivity". BMJ. 351: h4347. doi:10.1136/bmj.h4347. PMC 4596973. PMID 26438584.
- ^ Rewers M (April 2005). "Epidemiology of celiac disease: what are the prevalence, incidence, and progression of celiac disease?" (PDF). Gastroenterology. 128 (4 Suppl 1): S47–51. doi:10.1053/j.gastro.2005.02.030. PMID 15825126. Archived (PDF) from the original on 14 April 2007.
- ^ Guandalini S, Assiri A (March 2014). "Celiac disease: a review". JAMA Pediatrics. 168 (3): 272–8. doi:10.1001/jamapediatrics.2013.3858. PMID 24395055.
- ^ Catassi C, Rätsch IM, Gandolfi L, Pratesi R, Fabiani E, El Asmar R, Frijia M, Bearzi I, Vizzoni L (August 1999). "Why is coeliac disease endemic in the people of the Sahara?". Lancet. 354 (9179): 647–8. doi:10.1016/S0140-6736(99)02609-4. PMID 10466670. S2CID 9242679.
- ^ "Coeliac Disease - Coeliac Australia". www.coeliac.org.au. Retrieved 8 May 2019.
- ^ Houlston RS, Ford D (1996). "Genetics of coeliac disease". QJM. 89 (10): 737–43. doi:10.1093/qjmed/89.10.737. PMID 8944229.
- ^ Buchanan N (1987). Child and Adolescent Health for Practitioners. Williams & Wilkins. p. 164. ISBN 978-0-86433-015-4.
- ^ Zipser RD, Farid M, Baisch D, Patel B, Patel D (2005). "Physician awareness of celiac disease: a need for further education". J Gen Intern Med. 20 (7): 644–6. doi:10.1007/s11606-005-0111-7. PMC 1490146. PMID 16050861.
- ^ Jump up to:a b Barker JM, Liu E (2008). "Celiac disease: pathophysiology, clinical manifestations, and associated autoimmune conditions". Adv Pediatr. 55: 349–65. doi:10.1016/j.yapd.2008.07.001. PMC 2775561. PMID 19048738.
- ^ Leeds JS, Hopper AD, Sanders DS (2008). "Coeliac disease". Br Med Bull. 88 (1): 157–70. doi:10.1093/bmb/ldn044. PMID 19073695.
- ^ Jump up to:a b Oxentenko, AS; Rubio-Tapia, A (December 2019). "Celiac Disease". Mayo Clinic Proceedings. 94 (12): 2556–2571. doi:10.1016/j.mayocp.2019.02.019. PMID 31806106.
- ^ Jump up to:a b c Adams F, translator (1856). "On The Cœliac Affection". The extant works of Aretaeus, The Cappadocian. London: Sydenham Society. pp. 350–1. Retrieved 12 December 2009.
- ^ Jump up to:a b c d e f Losowsky MS (2008). "A history of coeliac disease". Digestive Diseases. 26 (2): 112–20. doi:10.1159/000116768. PMID 18431060. S2CID 10062937.
- ^ Gee, SJ (1888). "On the coeliac affection". St Bartholomew's Hospital Report. 24: 17–20. Archived from the original on 26 September 2007. Retrieved 20 March 2007.
- ^ Herter, CA (1908). On infantilism from chronic intestinal infection; characterized by the overgrowth and persistence of flora in the nursing period. New York: Macmillan & Co. as cited by WhoNamedIt
- ^ Enersen OD. "Christian Archibald Herter". Who Named It?. Archived from the original on 31 December 2006. Retrieved 20 March 2007.
- ^ Haas SV (1924). "The value of the banana in the treatment of coeliac disease". Am J Dis Child. 24 (4): 421–37. doi:10.1001/archpedi.1924.04120220017004.
- ^ van Berge-Henegouwen GP, Mulder CJ (1993). "Pioneer in the gluten free diet: Willem-Karel Dicke 1905–1962, over 50 years of gluten free diet". Gut. 34 (11): 1473–5. doi:10.1136/gut.34.11.1473. PMC 1374403. PMID 8244125.
- ^ Dicke WK (1950). Coeliakie: een onderzoek naar de nadelige invloed van sommige graansoorten op de lijder aan coeliakie, PhD thesis (in Dutch). Utrecht, the Netherlands: University of Utrecht.
- ^ Fasano A (2009). "Celiac Disease Insights: Clues to Solving Autoimmunity". Scientific American (August): 49–57. Archived from the original on 8 February 2010.
- ^ Anderson CM, French JM, Sammons HG, Frazer AC, Gerrard JW, Smellie JM (1952). "Coeliac disease; gastrointestinal studies and the effect of dietary wheat flour". Lancet. 1 (17): 836–42. doi:10.1016/S0140-6736(52)90795-2. PMID 14918439.
- ^ Paulley JW (1954). "Observation on the aetiology of idiopathic steatorrhoea; jejunal and lymph-node biopsies". Br Med J. 2 (4900): 1318–21. doi:10.1136/bmj.2.4900.1318. PMC 2080246. PMID 13209109.
- ^ Macdonald WC, Dobbins WO, Rubin CE (1965). "Studies of the familial nature of celiac sprue using biopsy of the small intestine". N Engl J Med. 272 (9): 448–56. doi:10.1056/NEJM196503042720903. PMID 14242522.
- ^ "Buy Me Some Gluten-Free Peanuts, Cracker Jacks". QSR Magazine. Journalistic. 11 May 2010. Archived from the original on 4 December 2011. Retrieved 30 December2010.
- ^ Hillson, Beth (9 January 2008). "May as Celiac Awareness Month". Celiac Disease Foundation. Archived from the original on 24 February 2010. Retrieved 1 July 2011.
- ^ One on-line site sells 1200 wafers weighing a total of 523 g Archived 16 September 2011 at the Wayback Machine. Eden.co.uk (31 July 2013). Retrieved on 3 September 2013.
- ^ Statement by the National Conference of Catholic bishops on the use of low gluten hosts at Mass Archived 16 July 2013 at the Wayback Machine. BCL Newsletter. November 2003.
- ^ "Girl with digestive disease denied Communion". NBC News. Microsoft. Associated Press. 8 December 2004. Retrieved 30 May 2006.
- ^ Ratzinger, Joseph (24 July 2003). Prot. 89/78-174 98. Congregation for the Doctrine of the Faith. Full text at: "The Use of Mustum and Low-Gluten Hosts at Mass". BCL Newsletter. United States Conference of Catholic Bishops. November 2003. Archived from the original on 2 January 2007. Retrieved 7 March 2007.
- ^ McNamara, Father Edward (15 September 2004). "Liturgy: Gluten-free Hosts". Catholic Online. Archived from the original on 29 September 2007. Retrieved 17 June 2007.
- ^ Millward, David (8 July 2017). "Vatican outlaws use of gluten free bread for Holy Communion". The Telegraph. Archivedfrom the original on 4 August 2017. Retrieved 3 August 2017.
- ^ "COELIAC DISEASE | meaning in the Cambridge English Dictionary". dictionary.cambridge.org. Retrieved 15 December 2018.
- ^ "Coeliac vs. Celiac". www.glutenfreedublin.com. Retrieved 15 December 2018.
- ^ Kemppainen KM, Lynch KF, Liu E, Lönnrot M, Simell V, Briese T, et al. (May 2017). "Factors That Increase Risk of Celiac Disease Autoimmunity After a Gastrointestinal Infection in Early Life". Clinical Gastroenterology and Hepatology. 15(5): 694–702.e5. doi:10.1016/j.cgh.2016.10.033. PMC 5576726. PMID 27840181.
- ^ Verdu EF, Caminero A (April 2017). "How infection can incite sensitivity to food". Science. 356 (6333): 29–30. Bibcode:2017Sci...356...29V. doi:10.1126/science.aan1500. PMID 28385972. S2CID 206659081.
- ^ Freeman HJ (November 2013). "Non-dietary forms of treatment for adult celiac disease". World Journal of Gastrointestinal Pharmacology and Therapeutics (Review). 4(4): 108–12. doi:10.4292/wjgpt.v4.i4.108. PMC 3817285. PMID 24199026.
- ^ Vanga RR, Kelly CP (May 2014). "Novel therapeutic approaches for celiac disease". Discovery Medicine. 17 (95): 285–93. PMID 24882720.
- ^ Jump up to:a b Castillo NE, Theethira TG, Leffler DA (2015). "The present and the future in the diagnosis and management of celiac disease". Gastroenterology Report (Review). 3 (1): 3–11. doi:10.1093/gastro/gou065. PMC 4324867. PMID 25326000.
- ^ "Innovate Biopharmaceuticals". www.innovatebiopharma.com. Archived from the original on 18 April 2016. Retrieved 17 April 2016.
- ^ Jump up to:a b Buie T (2013). "The relationship of autism and gluten". Clin Ther (Review). 35 (5): 578–83. doi:10.1016/j.clinthera.2013.04.011. PMID 23688532. At this time, the studies attempting to treat symptoms of autism with diet have not been sufficient to support the general institution of a gluten-free or other diet for all children with autism.
- ^ Marí-Bauset S, Zazpe I, Mari-Sanchis A, Llopis-González A, Morales-Suárez-Varela M (December 2014). "Evidence of the gluten-free and casein-free diet in autism spectrum disorders: a systematic review". J Child Neurol. 29 (12): 1718–27. doi:10.1177/0883073814531330. hdl:10171/37087. PMID 24789114. S2CID 19874518.
- ^ Millward C, Ferriter M, Calver S, Connell-Jones G (2008). Ferriter M (ed.). "Gluten- and casein-free diets for autistic spectrum disorder". Cochrane Database Syst Rev (2): CD003498. doi:10.1002/14651858.CD003498.pub3. PMC 4164915. PMID 18425890.
- ^ Volta U, Caio G, De Giorgio R, Henriksen C, Skodje G, Lundin KE (June 2015). "Non-celiac gluten sensitivity: a work-in-progress entity in the spectrum of wheat-related disorders". Best Pract Res Clin Gastroenterol. 29 (3): 477–91. doi:10.1016/j.bpg.2015.04.006. PMID 26060112. autism spectrum disorders (ASD) have been hypothesized to be associated with NCGS [47,48]. Notably, a gluten- and casein-free diet might have a positive effect in improving hyperactivity and mental confusion in some patients with ASD. This very exciting association between NCGS and ASD deserves further study before conclusions can be firmly drawn
- ^ San Mauro I, Garicano E, Collado L, Ciudad MJ (December 2014). "¿Es el gluten el gran agente etiopatogenico de enfermedad en el siglo XXI?" [Is gluten the great etiopathogenic agent of disease in the XXI century?]. Nutr Hosp (in Spanish). 30 (6): 1203–10. doi:10.3305/nh.2014.30.6.7866. PMID 25433099.